
【题目】若NA表示阿佛加德罗常数,下列说法正确的是:
A. 14 g 氮气中含有7NA个电子
B. 1 mol Cl2作为氧化剂得到的电子数为NA
C. 标准状况下,2. 24 L的CCl4中含有的C—Cl键数为0. 4NA
D. 常温常压下,3. 0 g含甲醛的冰醋酸中含有的原子总数为0. 4NA
科目:高中化学 来源: 题型:
【题目】下面是元素周期表的一部分,参照元素①~⑧在表中的位置,请用化学用语回答下列问题:
周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)④、⑤、⑧三种元素中,离子半径大小的顺序为__>__>__(填离子符号)。
(2)②、⑦、⑧的最高价含氧酸酸性由强到弱的顺序是(填化学式)___>__>__。
(3)⑥单质与⑤的最高价氧化物的水化物反应的离子方程式为________________。
(4)能说明⑧的非金属性比⑨的非金属性________(填“强”或“弱”)的事实是: _________________(用离子方程式说明)。
(5)①和③形成的18电子的化合物甲是一种应用广泛的化工原料,写出甲的电子式___________,实验室中可用次氯酸钠溶液与氨反应制备甲,反应的化学方程式为___________________,甲可用于处理高压锅炉水中的氧,防止锅炉被腐蚀,理论上1kg的甲可除去水中溶解的O2________kg。
(6)常温下,由①②组成10电子的化合物乙可作为燃料电池的原料之一,请写出乙在碱性介质中的电极反应式:正极:____________________;负极_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.三氧化二铁可以用来制作油漆
B.可用超纯硅制造的单晶硅来制造计算机的芯片
C.实验室用二氧化锰和浓盐酸共热制取少置氯气
D.氢氧化钠溶液要盛放在磨口玻璃塞的试剂瓶里
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为_________________________________;漂白粉的有效成分是____________(填化学式)。
(2)氨气(NH3)在工农业中应用广泛。氯化铵是常用氮肥,工厂将氨气和氯化氢混合制氯化铵的化学方程式为_____________________;实验室制取氨气选用________________(填试剂名称)来干燥氨气。
(3)下图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。
硫酸具有A-D所示的性质,以下过程主要表现了浓硫酸的那些性质?请将选项字母填在下列各小题的括号内:

A强酸性 B 吸水性 C 脱水性 D 强氧化性
①浓硫酸可以干燥氢气(____________)
②浓硫酸使木条变黑(____________)
③热的浓硫酸与铜片反应(____________)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2OCO(g)+H2(g)△H>0,达到平衡时,下列说法正确的是
A. 加入催化剂,平衡常数不变
B. 减小容器体积,正、逆反应速率均减小
C. 增大C的量,H2O的转化率增大
D. 升高温度,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
A.催化剂V2O5不改变该反应的逆反应速率
B.增大反应体系的压强,反应速率一定增大
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中的实验装置可用于制取乙炔。
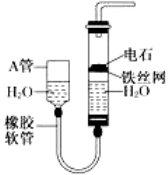
请填空:
(1)图中,A管的作用是____________,制取乙炔的化学方程式是______________。
(2)实验时常滴加饱和食盐水而不直接滴加水,其目的是________________,为了除去反应后的气体杂质,常选用___________试剂。
(3)乙炔通入溴的CCl4溶液中观察到的现象是_____________,乙炔发生了________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计实验以探究元素性质的递变规律,实验装置如图所示.
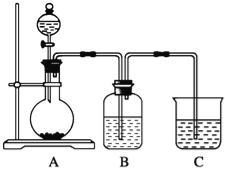
实验Ⅰ:根据元素最高价含氧酸的酸性强弱探究元素非金属性递变规律.
已知A装置的烧瓶里装有大理石,分液漏斗里装有稀HNO3,B装置中装有饱和碳酸氢钠溶液,装置C中装有Na2SiO3溶液,试回答:
(1)A中反应的离子方程式为 ,C中可观察到的现象是 .
(2)B装置的作用是 .
(3)根据实验现象推知,碳酸、硝酸、硅酸的酸性强弱顺序是 ,由此得出碳、硅、氮三种元素非金属性的强弱顺序是 .
实验Ⅱ:已知常温下高锰酸钾与浓盐酸混合可产生氯气,利用该装置探究氯和溴元素的非金属性强弱.
(4)写出B装置中发生反应的离子方程式: .
(5)C装置的作用是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa=-lgKa,25℃时,H2SO3的 pKa1=1.85,pKa2=7.19.用0.1molL-1NaOH溶液滴定20mL0.1molL-1H2SO3溶液的滴定曲线如图所示(曲线上的数字为pH).下列说法不正确的是( )

A.a点所得溶液中:2c(H2SO3)+c(SO32-)<0.1 molL-1
B.b点所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-)
C.c点所得溶液中:c(Na+)<3c(HSO3 )
D.d点所得溶液中:c(Na+)>c(SO32-)>c(HSO3-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com