
| A. | 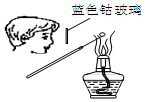 检验Na2CO3 中的Na+ | B. | 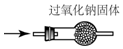 除去CO中混有的CO2 | ||
| C. | 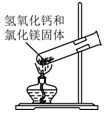 制取氨气 | D. | 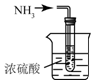 吸收氨气 |
分析 A.观察钠离子的火焰颜色,不需要透过蓝色钴玻璃;
B.一氧化碳不与氢氧化钠固体反应,二氧化碳与氢氧化钠反应;
C.给固体加热时,大试管口应稍稍向下倾斜;
D.稀释氨气时应该使用防倒吸装置.
解答 解:A.检验Na2CO3 中的Na+,可直接观察火焰颜色,不需要蓝色钴玻璃,故A错误;
B.CO不与NaOH反应,可用NaOH除去CO中混有的CO2,故B正确;
C.加热氯化铵和氢氧化钙固体制取氨气时,大试管口应该稍稍向下倾斜,图示装置不合理,故C错误;
D.氨气极易溶于水,吸收氨气时,应该用防止倒吸装置,图示装置会发生倒吸,故D错误;
故选B.
点评 本题考查了化学实验方案的评价,题目难度不大,涉及焰色反应、物质分离与除杂、氨气制取及尾气吸收等知识,明确常见化学实验基本操作方法为解答关键,试题侧重基础知识的考查,有利于提高学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | 达到平衡时,X与Y 的浓度相等 | |
| B. | 将容器体积变为20 L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 以X浓度变化表示的反应速率为0.01 mol/(L•s) | |
| D. | 若升高温度Y的转化率减小,则正反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AI溶解于氢氧化钠溶液中 | B. | Na与水反应 | ||
| C. | Na2O2与水反应 | D. | Fe与水蒸气在高温下反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 5:3 | C. | 3:2 | D. | 7:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
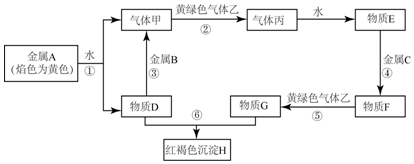
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑦ | B. | ②④⑥ | C. | ①⑥⑦ | D. | ①②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该合金中铁的质量为5.4 g | |
| B. | 合金与稀硫酸反应共生成0.45 mol H2 | |
| C. | 该合金与足量氢氧化钠溶液反应,转移的电子数为0.3NA | |
| D. | 所加的稀硫酸中含0.6 mol H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com