
分析 根据元素周期表结构可知,若四种元素都是第二、第三周期元素,原子序数之和最小为Li、Na,其原子序数之和为3+11=14,最大为F、Cl,其原子序数之和为:9+17=26,不可能满足2倍的关系;所以一定含有H元素,ⅠA族的另一种元素只能为Na,二者的原子序数之和为:11+1=12,另外两种同主族短周期元素的原子序数之和为12×2=24,设一种元素的原子序数为x,另一种元素的原子序数为x+8,则x+x+8=24,解得:x=8,为O元素,另一种为S元素,据此进行解答.
解答 解:根据元素周期表结构可知,若四种元素都是第二、第三周期元素,原子序数之和最小为Li、Na,其原子序数之和为3+11=14,最大为F、Cl,其原子序数之和为:9+17=26,不可能满足2倍的关系;所以一定含有H元素,ⅠA族的另一种元素只能为Na,二者的原子序数之和为:11+1=12,另外两种同主族短周期元素的原子序数之和为12×2=24,设一种元素的原子序数为x,另一种元素的原子序数为x+8,则x+x+8=24,解得:x=8,为O元素,另一种为S元素,
根据分析可知,四种元素分别为H、Na、O、S元素,由这4种元素组成的2种化合物分别为NaHSO4、NaHSO3,二者反应生成硫酸钠、二氧化硫气体和水,反应的离子方程式为:H++HSO3-=SO2↑+H2O,
故答案为:H++HSO3-=SO2↑+H2O.
点评 本题考查了原子结构与元素的性质,题目难度中等,推断元素为解答关键,注意掌握原子结构与元素周期表的关系,试题培养了学生的分析能力及灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
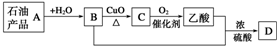
| A. | A能使酸性高锰酸钾溶液褪色 | B. | 可用B萃取碘水中的碘单质 | ||
| C. | B与乙酸发生了取代反应 | D. | D的结构简式为CH3COOCH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
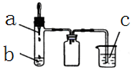 利用如图所示装置进行下列实验,实验现象与结论均正确的是( )
利用如图所示装置进行下列实验,实验现象与结论均正确的是( )| 选项 | 实验试剂 | 实验现象 | 实验结论 | ||
| a | b | c | |||
| A | 浓氨水 | 碱石灰 | FeCl2溶液 | 产生白色沉淀,迅速变为灰绿色,最后变为红褐色 | 氨气具有氧化性 |
| B | 稀硫酸 | FeS | AgCl悬浊液 | 悬浊液由白色变为黑色 | Ksp(AgCl)>Ksp(Ag2S) |
| C | 浓硝酸 | 铜 | BaSO3悬浊液 | 悬浊液变澄清 | +4价硫具有还原性 |
| D | 浓盐酸 | KMnO4 | 紫色石蕊试液 | 溶液先变红后褪色 | Cl2有酸性和漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由X、Y、Z三种元素形成的某种化合物,可能含有离子键 | |
| B. | 五种元素分别形成的单核离子中,M的离子半径最大 | |
| C. | W的氯化物是由一种10e-离子和一种18e-离子构成的 | |
| D. | X元素与Z所在主族的各元素形成的A2B型化合物中X2Z沸点最低 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 “酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们可以用如图所示的装置制取乙酸乙酯:
“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们可以用如图所示的装置制取乙酸乙酯:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图中反应Ⅰ、Ⅱ、Ⅲ均为氧化还原反应 | |
| B. | 图中反应Ⅰ、Ⅱ、Ⅲ均可在常温常压下进行 | |
| C. | 整个循环过程中产生1mol O2的同时产生44.8LH2 | |
| D. | 设计该循环是为了制取能源气体H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10:7:11 | B. | 11:11:8 | C. | 11:10:8 | D. | 10:11:8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业上,可以由下列反应合成三聚氰胺:
工业上,可以由下列反应合成三聚氰胺: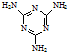 .其中氮原子的杂化方式有sp2、sp3.
.其中氮原子的杂化方式有sp2、sp3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
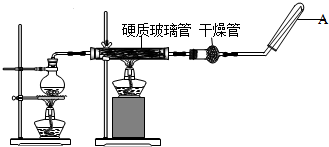
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com