
(16分)
已知: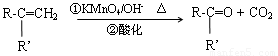 (R、R’表示烃基或官能团)
(R、R’表示烃基或官能团)
有机物A是一种医药中间体,质谱图显示其相对分子质量为130。已知0.5 mol A完全燃烧只生成3 mol CO2和2.5 mol H2O。A可发生如下图所示的转化,其中D的分子式为C4H6O2,两分子F反应可生成六元环状酯类化合物。
请回答:
(1)1 mol B与足量的金属钠作用产生22.4 L(标准状况)H2。B中所含官能团的名称是 。
B与C的相对分子质量之差为4,B→C的化学方程式是 。
(2)D的同分异构体G所含官能团与D相同,则G的结构简式可能是 、 。
(3)F可发生多种类型的反应。
①两分子F反应生成的六元环状酯类化合物的结构简式是 ;
②F可制得使Br2的CCl4溶液褪色的有机物H。F→H的化学方程式是 ;
③F在一定条件下发生缩聚反应的化学方程式是 。
(4)A的结构简式是 。
科目:高中化学 来源: 题型:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 500 | 4600 | 6900 | 9500 |
| B | 740 | 1500 | 7700 | 10500 |
| R | 580 | 1800 | 2700 | 11600 |
| 3 |
| 4 |
| 1 |
| 2 |
| 3 |
| 4 |
| 1 |
| 2 |
| 3 |
| 4 |
| 3 |
| 4 |
| 1 |
| 2 |
| 3 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素性质 | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 氢化物的沸点(℃) | -60.7 | -33.4 | -111.5 | 100 | -87.7 | 19.54 | -84.9 | -161.5 |
| 最高化合价 | +6 | +5 | +4 | +5 | +7 | +4 | ||
| 最低化合价 | -2 | -3 | -4 | -2 | -3 | -1 | -1 | -4 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 | 熔点/K | 993 | 1539 | 183 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| J | ||||
| R |
| A、J和氢组成的化合物分子中只含有极性共价键 |
| B、工业上用电解M和T组成的化合物来制备M |
| C、R、T两元素的气态氢化物中,T的气态氢化物更稳定 |
| D、J、M、R、T元素最高价氧化物对应的水化物中酸性最强的是HTO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 电离能/(kJ?mol-1) | I1 | I2 | I3 | I4 | I5 |
| Y | 584 | 1823 | 2751 | 11584 | 14837 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com