
ij����M�����ȵ��ʸߡ������µ��Ե�Ժá������²���ǿ�ȴ������������ܣ�����⣬M��ֻ�������ֶ�����Ԫ�أ���ȡ82gM����������NaOH��Һ��ǡ�÷�Ӧ���õ���ɫ��ҺA��44.8L����B���������Ϊ��״���£�����������ʹ��ɫʯ����ֽ����������Ӧ�����Һ����μ������ᣬ�ɹ۲쵽��Һ�ȱ���Ǻ����壮
����B������ת����ϵ��BCD EE��һ��ǿ�ᣮ��c��D�Ļ�����ܽ��ڽӽ���ȵ�ˮ�У����ɵõ�һ������F��ˮ��Һ����ش��������⣺
EE��һ��ǿ�ᣮ��c��D�Ļ�����ܽ��ڽӽ���ȵ�ˮ�У����ɵõ�һ������F��ˮ��Һ����ش��������⣺
��1������M�Ļ�ѧʽΪ�����������������壨����ӡ��������ӡ�����ԭ�ӡ��ȣ���
��2����ɫ��ҺA�ʼ��ԣ���ԭ���������������ӷ���ʽ��ʾ����
��3������F��һ�ֱȴ���������ǿ�����ᣬ�ܲ��ȶ���ͨ�����������ֽ⣮Ҫ�Ƶ�F��Һ���������䶳��������Ũ��Һ�м����ͨ��ij�����ʣ��������ʲ��ʺ�ʹ�õ�������������ţ���
a������ b��������̼ c��ϡ���� d����������
��4����ҵ���Է�ˮ��������NO��2���������۳�ȥ����֪�˷�Ӧ��ϵ�м�B���壮д��������Ӧ�����ӷ���ʽ�����������õ�ⷨ����ˮ��NO��2ת��ΪN2��ȥ��N2������������������������������ɣ��缫��ӦΪ������
��5���ַ���һ�ֻ��Ժ�ǿ�Ļ�����G�������ΪNH5��G��ˮ�ܲ����������壬����һ������ΪB��������G�ĵ���ʽΪ������
| ������ƶϣ�. | |
| ר�⣺ | �ƶ��⣮ |
| ������ | ij����M�����ȵ��ʸߡ������µ��Ե�Ժá������²���ǿ�ȴ������������ܣ�����⣬M��ֻ�������ֶ�����Ԫ�أ���ȡ82gM����������NaOH��Һ��ǡ�÷�Ӧ���õ���ɫ��ҺA��44.8L����B���������Ϊ��״���£�����������ʹ��ɫʯ����ֽ�������������B�ǰ���������Ӧ�����Һ����μ������ᣬ�ɹ۲쵽��Һ�ȱ���Ǻ����壬��Ӧ�����Һ������A��ƫ�����ƣ�����Ԫ���غ�֪��M�ǵ������� ����B������ת����ϵ��BCD |
| ��� | �⣺ij����M�����ȵ��ʸߡ������µ��Ե�Ժá������²���ǿ�ȴ������������ܣ�����⣬M��ֻ�������ֶ�����Ԫ�أ���ȡ82gM����������NaOH��Һ��ǡ�÷�Ӧ���õ���ɫ��ҺA��44.8L����B���������Ϊ��״���£�����������ʹ��ɫʯ����ֽ�������������B�ǰ���������Ӧ�����Һ����μ������ᣬ�ɹ۲쵽��Һ�ȱ���Ǻ����壬��Ӧ�����Һ������A��ƫ�����ƣ�����Ԫ���غ�֪��M�ǵ������� ����B������ת����ϵ��BCD ��1��ͨ�����Ϸ���֪��M��AlN�����ݵ�������ǿ��֪����������ԭ�Ӿ��壬�ʴ�Ϊ��AlN��ԭ�ӣ� ��2����ɫ��ҺA�ʼ��ԣ���Ϊƫ��������ǿ�������Σ�ƫ���������ˮ���ʹ��Һ������������Ũ�ȴ���������Ũ�ȣ�������Һ�ʼ��ԣ�ˮ�ⷽ��ʽΪ��AlO2��+2H2O=Al��OH��3+OH�����ʴ�Ϊ��AlO2��+2H2O=Al��OH��3+OH���� ��3������������Աȴ���ǿ���������������Ա�������ǿ��̼������������������ǿ����ȡ����֪��������̼����ȡ�����ᣬ���������ǿ�����ԣ���������л�ԭ�ԣ���������������ԭ��Ӧ����ѡbd�� ��4������������Ӻ��������������ӷ�Ӧ����ƫ��������ӺͰ��������ӷ�Ӧ����ʽΪ2Al+NO2��+OH��+H2O=2AlO2��+NH3���������õ�ⷨ����ˮ��NO��2ת��ΪN2��ȥ����������õ������ɵ���������Ӧ�������������ɣ��缫��ӦʽΪ��2NO2��+6e��+4H2O=N2+8OH���� �ʴ�Ϊ��2Al+NO2��+OH��+H2O=2AlO2��+NH3����������2NO2��+6e��+4H2O=N2+8OH���� ��5��һ�ֻ��Ժ�ǿ�Ļ�����G�������ΪNH5��G��ˮ�ܲ����������壬����һ������ΪB����һ�������������������Ȼ�淋ľ�������֪��G�����ӻ������������G�ĵ���ʽΪ�� |
| ������ | ���⿼����ۺϣ���ȷ�ƶ�Ԫ�صĽⱾ��ؼ����������ʽṹ��������������ɣ��Ѷ��еȣ� |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����˵����ȷ���ǣ���Cl���Ľṹʾ��ͼ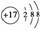 ���ǻ��ĵ���ʽ��·
���ǻ��ĵ���ʽ��·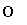 H�� ��HClO�Ľṹʽ��H—Cl—O����NaHCO3��ˮ�еĵ��뷽��ʽ��NaHCO3===Na����H����CO�� ��Na2O��ˮ��Һ�ܵ��磬�ⲻ��˵��Na2O�ǵ���ʣ� ��SiO2����������ᷴӦ������NaOH��Һ��Ӧ����SiO2������������߷������ѻ����ǻ�ѧ�仯�� ��
H�� ��HClO�Ľṹʽ��H—Cl—O����NaHCO3��ˮ�еĵ��뷽��ʽ��NaHCO3===Na����H����CO�� ��Na2O��ˮ��Һ�ܵ��磬�ⲻ��˵��Na2O�ǵ���ʣ� ��SiO2����������ᷴӦ������NaOH��Һ��Ӧ����SiO2������������߷������ѻ����ǻ�ѧ�仯�� ��
A���٢ڢ� B���٢ܢޢ� C���ڢۢܢ� D���ڢۢݢޢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij��ˮ�п��ܴ��ڵ��������£�Na+��Ag+��Ba2+��Al3+��AlO2һ��CO32����S2һ��SO32����SO42��
��ȡ����Һ�����й�ʵ�飬ʵ����̼��������£�
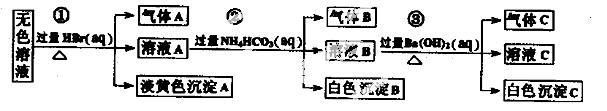
����˵����ȷ����
A������ʵ����е�������Ƴ�������Aһ���Ǵ��������ɫ����һ����AgBr
B������ʵ����е�������Ƴ�������B��CO2������B��Al(OH)3��ԭ��Һ��һ������Al3+
C������ʵ����е�������Ƴ�������C��NH3������Cһ����BaCO3��������BaSO4
D��ԭ��Һ�п϶�����Na+��AlO2����S2��������ȷ���Ƿ���SO32����SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�йغ����в�����Դ�����ã���ͼ����˵������ȷ���ǣ�������
| �� | A�� | ��ҵ������Cl2�����ʯ��ˮ��Ӧ��ȡƯ�� |
| �� | B�� | ��MgCl2•6H2O��������ˮMgCl2������HCl�����м�����ˮ |
| �� | C�� | SO2ˮ��Һ����Br2�Ļ�ѧ����ʽΪBr2+SO2+2H2O�TH2SO4+2HBr |
| �� | D�� | �ֵ��л�������ICl��IBr���ɼ���KI���������ᴿ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪ij��ѧ��Ӧ��ƽ�ⳣ������ʽΪK=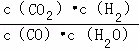 ���ڲ�ͬ���¶��¸÷�Ӧ��ƽ�ⳣ�����±���
���ڲ�ͬ���¶��¸÷�Ӧ��ƽ�ⳣ�����±���
| t�� | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
�����й���������ȷ���ǣ�������
| �� | A�� | �÷�Ӧ�Ļ�ѧ����ʽ��CO��g��+H2O��g���TCO2��g��+H2��g�� |
| �� | B�� | ������Ӧ������Ӧ�Ƿ��ȷ�Ӧ |
| �� | C�� | ����һ��������ܱ�������ͨ��CO2��H2��1mol��5 min���¶����ߵ�830�棬��ʱ���CO2Ϊ0.4 molʱ���÷�Ӧ�ﵽƽ��״̬ |
| �� | D�� | ��ƽ��Ũ�ȷ������й�ϵʽ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
С����ʵ��ʱ��С��մ��һЩKMnO4��Ƥ���ϵĺڰߺܾò�������������ò����ϡ��Һϴ�����Ͽ��Ը�ԭ�������ӷ���ʽΪ��MnO4��+H2C2O4+H+��CO2��+Mn2++����δ��ƽ�������ڴ˷�Ӧ��������ȷ���ǣ�������
| �� | A�� | �÷�Ӧ����������H2C2O4 | B�� | 1molMnO4���ڷ�Ӧ��ʧȥ5mol���� |
| �� | C�� | �÷�Ӧ�ҿ��ڵIJ�����OH�� | D�� | ��ƽ�÷�Ӧ��H+�ļ�������6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ʵ���������۱�����ȷ���ǣ�������
| �� | A�� | ֽ����ʵ������ѡ��ˮ���̶��࣬�л��ܼ��������࣬����ˮ��ǿ�ijɷ����������з������һЩ����ëϸ���������£����������ƶ����ٶȿ�һЩ |
| �� | B�� | �ж�CuO��MnO2��H2O2�ֽ�Ĵ�Ч�ʣ���ͨ���Ƚ�H2O2��Һ�������ݵĿ����̶ȣ���ⶨ��λʱ���ڲ������������ |
| �� | C�� | ʳ�����Ậ���ⶨʵ���У�ʵ�����ʱ��ʽ�ζ��ܼ��첿λ�����ݣ���ⶨ�Ĵ��Ậ��ƫ�� |
| �� | D�� | ����������������淋Ļ����Һ����Ũ������ȴ�ᾧ�������Ħ���δֲ�Ʒ�����þƾ�ϴȥ��������ˮ�֣����Ⱥ�ɺ���أ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
NaCl��һ�ֻ���ԭ�ϣ������Ʊ�һϵ�����ʣ���ͼ��ʾ��������˵����ȷ���ǣ�������
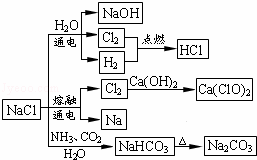
| �� | A�� | ʯ������Cl2�ķ�Ӧ��Cl2���������������ǻ�ԭ�� |
| �� | B�� | 25�棬NaHCO3��ˮ�е��ܽ�ȱ�Na2CO3�Ĵ� |
| �� | C�� | �����¸���Cl2���ø�ƿ���ˣ�����Cl2��������Ӧ |
| �� | D�� | ͼ����ʾת����Ӧ����������ԭ��Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�±������ۺ������� (����)
| ѡ�� | ��ѧ��Ӧ�������ӷ���ʽ | ���� |
| A | Fe3O4��ϡ���ᷴӦ��2Fe3O4��18H��===6Fe3����H2����8H2O | ��ȷ |
| B | ��̼��þ�м���ϡ���CO | ����̼��þ��Ӧд��������ʽ |
| C | ���������Һ�м�������������Һ�� Ba2����SO | ��ȷ |
| D | FeBr2��Һ������ʵ�����Cl2��Ӧ�� 2Fe2����2Br����2Cl2===2Fe3����4Cl����Br2 | ����Fe2����Br���Ļ�ѧ������֮��ӦΪ1��2 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com