
| A. | 99 | B. | 67 | C. | 32 | D. | 166 |
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源:2016-2017学年辽宁省高一上10月月考化学卷(解析版) 题型:选择题
下列叙述中正确的有几个
①标准状况下,1LHCl和1LH2O的物质的量相同
②标准状况下,1gH2和14gN2的体积相同
③28gCO的体积为22.4L
④两种物质的物质的量相同,则它们在标准状况下的体积也相同
⑤同温同体积时,气体物质的物质的量越大,则压强越大
⑥同温同压下,气体的密度与气体的相对分子质量呈正比
A.2个 B.3个 C.4个 D.5个
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +45.2 kJ•mol-1 | B. | -45.2 kJ•mol-1 | C. | -69.4 kJ•mol-1 | D. | +69.4 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5Q2-1.5Q1-0.5Q3 | B. | 0.5(Q1+Q2+Q3) | ||
| C. | 0.5 Q1-1.5 Q2+0.5Q3 | D. | 1.5Q1-0.5Q2+0.5Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溶质的电离方程式为NaHCO3═Na++H++CO32- | |
| B. | 25℃时,加水稀释后,c(H+)与c(OH-)的乘积不变 | |
| C. | 离子浓度关系:c(Na+)+c(H+)═c(OH-)+c(HCO3-)+c(CO32-) | |
| D. | 温度升高,c(HCO3-)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丁烷的一氯代物有5种 | B. | 丙烷分子中所有原子共平面 | ||
| C. | 符合通式CnH2n+2的均属于烷烃 | D. | 以上说法均不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
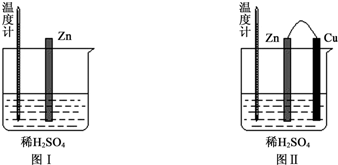
| 实验现象 | 解释原因 |
| Cu片上产生了大量气泡 | Zn、Cu构成原电池,H+在Cu片上得电子产生氢气 |
| 温度计指示的温度无明显变化 | 反应中的化学能主要转化成了电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g氮气所含有的原子数目为NA | |
| B. | 6g金属镁变成镁离子时失去的电子数目为为NA | |
| C. | 标准状况下,22.4L任何气体所含分子数都约为NA | |
| D. | 50mL 1mol/L NaCl溶液所含的Cl-物质的量0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com