
| m |
| M |
| 0.165g |
| 100g+0.165g |
| 0.888g |
| 74g/mol |
| 1.12L |
| 22.4L/mol |
| 1g |
| 100g/mol |
| ||


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 稀盐酸 | 水煤气 | 硫酸 | 醋酸 | 干冰 |
| B | 蒸馏水 | 蔗糖溶液 | 硫酸钡 | 一水合氨 | 二氧化硫 |
| C | 胆矾 | 稀硫酸 | 铁 | 水 | 碳酸钙 |
| D | 明矾 | 氢氧化铁胶体 | 氯化钠 | 次氯酸 | 氯气 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
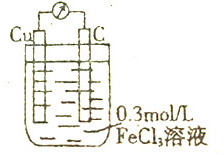
查看答案和解析>>
科目:高中化学 来源: 题型:

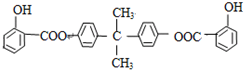
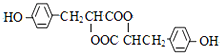
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4 600 | 6 900 | 9 500 |
| Y | 580 | 1 800 | 2 700 | 11 600 |
| A、X的单质常温下能与水剧烈反应 |
| B、若元素Y处于第3周期,它可与NaOH溶液反应 |
| C、元素X与氯形成化合物时,化学式为XCl |
| D、若元素Y处于第3周期,它与氯形成的化合物为离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、n(H2SO4)=0.6mol c(H2SO4)>6mol/L |
| B、n(H2SO4)=0.3mol c(H2SO4)≥3mol/L |
| C、n(H2SO4)<0.3mol c(H2SO4)<3mol/L |
| D、0.3mol≤n(H2SO4)≤0.6mol 3mol/L≤c(H2SO4)≤6mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
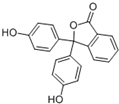
| A、分子式为C20H14O4 |
| B、可以发生取代反应、加成反应、氧化反应 |
| C、含有的官能团有羟基、酯基 |
| D、1mol该物质可与H2和溴水发生反应,消耗H2和Br2的最大值为10mol和4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将SO2通入BaCl2溶液中至饱和,无沉淀产生;再通人Cl2产生沉淀 |
| B、向AlC13溶液中加氨水,产生白色沉淀;再加入过量氨水,沉淀消失 |
| C、在稀硫酸中加入铜粉,铜粉不溶解;再加入NaNO3固体,铜粉溶解 |
| D、纯锌与稀硫酸反应产生氢气的速率较慢;再加入少量CuSO4固体,速率加快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com