
已知下列数据
| 化学键w.w.^w.k.&s.5*u.c.#om | H—H | Cl—Cl | H—Cl |
| 生成(拆开)1mol化学键放出(吸收)的能量 | 436kJ | 243kJ | 431kJ |
则下列热化学方程式不正确的是( )
A.![]() H2(g)+
H2(g)+![]() Cl2(g)==HCl(g) ;△H=-91.5kJ·mol-1
Cl2(g)==HCl(g) ;△H=-91.5kJ·mol-1
B.H2(g)+ Cl2(g)==2HCl(g) ;△H=-183kJ·mol-1
C.![]() H2(g)+
H2(g)+![]() Cl2(g)==HCl(g) ;△H=+91.5kJ·mol-1
Cl2(g)==HCl(g) ;△H=+91.5kJ·mol-1
D.2HCl(g) ==H2(g)+ Cl2(g) ;△H=+183kJ·mol-1
科目:高中化学 来源: 题型:
 某化学反应中,设反应物的总能量为E1,生成物的总能量为E2.
某化学反应中,设反应物的总能量为E1,生成物的总能量为E2.
| 盐 | 熔点/℃ | 熔化吸热/KJ?mol-1 | 参考价格/元?kg-1 |
| CaCL2?6H2O | 29,0 | 37,3 | 780~850 |
| Na2SO4?10H2O | 32,4 | 77,0 | 800~900 |
| Na2HPO4?12H2O | 36,1 | 100,1 | 1600~2000 |
| Na2S2O3?5H2O | 48,5 | 49,7 | 1400~1800 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相 关 信 息 |
| X | X的某种氢化物能使湿润的红色石蕊试纸变蓝 |
| Y | 单质是良好的半导体材料,广泛应用于光电信息领域 |
| Z | Z的一种核素质量数为27,中子数为14 |
| W | 最高价氧化物对应的水化物是一种不溶于水的蓝色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 4 |
| 1 |
| 2 |
| 1 |
| 4 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 物质 | 熔点(℃) | 沸点(℃) | 密度(g/cm3) |
| 乙醇 | -117.0 | 78.0 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸(98%) | - | 338.0 | 1.84 |
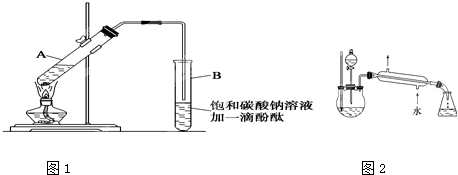
| 浓硫酸 |
| 加热 |
| 浓硫酸 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、-859 kJ?mol-1 | B、+859 kJ?mol-1 | C、-1403 kJ?mol-1 | D、-2491 kJ?mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com