
| A、酸性溶液中:Na+、K+、Fe3+、ClO- |
| B、溶液c(OH-)=10-12mol/L:NH4+、Al3+、NO3-、Cl- |
| C、某透明溶液:MnO4-、Mg2+、SO42-、Na+ |
| D、能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、S2-、SO32- |


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:
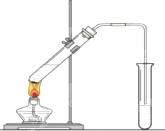 在实验室我们也可以用如图所示的装置制取乙酸乙酯.
在实验室我们也可以用如图所示的装置制取乙酸乙酯.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、+1 | B、+2 | C、+3 | D、+5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2-甲基丁烷和戊烷 |
| B、乙二醇和丙三醇 |
| C、2,2-二甲基-1-丙醇和2-甲基-2-丁醇 |
| D、苯甲醇和对甲基苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、反应在第4秒钟达到化学平衡状态,0~4秒内,以A表示的化学反应速率是 0.225 mol?L-1?s-1 |
| B、该温度下,压缩气体体积至1L,反应的平衡常数增大 |
| C、恒温条件下,缩小反应容器体积可以使反应的过程按图Ⅰ中a曲线进行 |
| D、在上述反应体系中加入催化剂,化学反应速率增大,则E1和E2均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
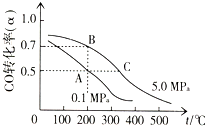 科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,产出了高热值的煤炭气,主要成分是CO和H2.
科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,产出了高热值的煤炭气,主要成分是CO和H2.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5 mol?L-1?s-1 |
| B、6 mol?L-1?s-1 |
| C、2 mol?L-1?s-1 |
| D、3 mol?L-1?s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸铝溶液中加入过量烧碱:Al3++3OH-=Al(OH)3↓ |
| B、碳酸钠溶液中加入醋酸:CO32-+2H+=CO2↑+H2O |
| C、碳酸氢钠溶液中加入氢氧化钠:HCO3-+OH-=CO32-+H2O |
| D、常温时,浓硝酸中加入铁片:Fe+6H++3NO3-=Fe3++3NO2↑+3H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com