
五种短周期元素A、B、C、D、E的原子序数依次增大。A和C同族,B和D同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性。回答下列问题:
(1)五种元素中,原子半径最大的是________,非金属性最强的是________(填元素符号)。
(2)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是________(用化学式表示)。
(3)A和E形成的化合物与A和B形成的化合物反应,产物的化学式为________,其中存在的化学键类型为________。
(4)D最高价氧化物的水化物的化学式为________。
(6)单质E与水反应的离子方程式为_______________________________________。
答案 (1)Na Cl (2)PH3 (3)NH4Cl 离子键和共价键
(4)H3PO4 (6)Cl2+H2OH++Cl-+HClO
解析 推断出具体元素,根据元素性质及其化合物的性质来解题。
由A和B、D、E三种元素均能形成共价型化合物,结合A和B形成的化合物的水溶液显碱性可知,A为H元素,B为N元素。由A、B、C原子序数依次增大,A和C同族,则C为Na元素。B和D同族,则D为P元素。又因为C和E形成的化合物在水中呈中性,可知E为Cl元素。
(1)根据同周期元素原子序数越大,原子半径越小,非金属性越强,同主族元素原子序数越大,原子半径越大,非金属性越弱可知,五种元素中,原子半径最大的是Na原子,非金属性最强的是Cl元素。
(2)非金属性越弱,氢化物的稳定性越差,故最不稳定的是PH3。
(3)HCl与NH3反应生成离子化合物NH4Cl,NH 和Cl-之间存在离子键,在NH
和Cl-之间存在离子键,在NH 中存在共价键。
中存在共价键。
(4)P的最高价氧化物为P2O5,其水化物为磷酸,化学式为H3PO4。
(6)氯气溶于水后 有一部分生成盐酸和次氯酸,但次氯酸是弱酸,不能完全电离,在离子方程式中写分子形式。
有一部分生成盐酸和次氯酸,但次氯酸是弱酸,不能完全电离,在离子方程式中写分子形式。


科目:高中化学 来源: 题型:
氯水中存在多种微粒,下列有关粒子的表示方法正确的是 ( )
A.氯气的电子式:Cl Cl
Cl
B.氢氧根离子的电子式: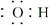
C.次氯酸分子的结构式:H—O—Cl
D.HClO的电子式: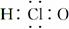
查看答案和解析>>
科目:高中化学 来源: 题型:
从化学键的观点看,化学反应的实质是“旧键的断裂,新键的形成”,据此你认为下列变化属于化学变化的是 ( )
①对空气进行降温加压 ②金刚石变成石墨 ③NaCl熔化
④碘溶于CCl4中 ⑤HCl溶于水电离出H+和Cl- ⑥电解熔融的Al2O3制取Al
A.②③⑤ B.②⑤⑥
C.②⑥ D.②③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
已知五种元素的原子序数的大小顺序为C>A>B>D>E,A、C同周期,B、C同主族。A与B形成的离子化合物A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子的分子。试回答下列问题:
(1)写出五种元素的元素符号:A:________、B:________、C:________、D:________、E:________。
(2)用电子式表示离子化合物A2B的形成过程:_______________________________
________________________________________________________________________。
(3)写出下列物质的电子式:
①D元素形成的单质:____________________________________________________。
②E与B形成的化合物:__________________________________________________。
③A、B、E形成的化合物:_______________________________________________。
④D与E形成的化合物:_________________________________________________。
⑤C、D、E形成的离子化合物:___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列描述中正确的是
A、CS2为V形的极性分子 B、ClO3-的空间构型为平面三角形
C、SF6中的空间构型为正四面体形 D、SiF4和SO32-的中心原子均为sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是一些常见有机物的转化关系,关于反应①~⑦的说法不正确的是 ( )

A.反应①是加成反应
B.只有反应②是加聚反应
C.只有反应⑦是取代反应
D.反应④⑤⑥是取代反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com