
【题目】FeCl2是一种常用的还原剂、媒染剂。某化学实验小组在实验室里用如下两种方法来制备无水FeCl2。有关物质的性质如下:
C6H5Cl(氯苯) | C6H4Cl2(二氯苯) | FeCl3 | FeCl2 | |
溶解性 | 不溶于水,易溶于苯、乙醇 | 不溶于C6H5Cl、C6H4Cl2、苯, 易溶于乙醇,易吸水 | ||
熔点/℃ | -45 | 53 | 易升华 | |
沸点/℃ | 132 | 173 | ||
(1)用H2还原无水FeCl3制取FeCl2。有关装置如下:

①H2还原无水FeCl3制取FeCl2的化学方程式为_______。
②按气流由左到右的方向,上述仪器的连接顺序为____(填字母,装置可多次使用);C中盛放的试剂是_____。
③该制备装置的缺点为______。
(2)利用反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl↑,制取无水FeCl2并测定FeCl3的转化率。按下图装置,在三颈烧瓶中放入32.5g无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却、分离提纯得到粗产品。
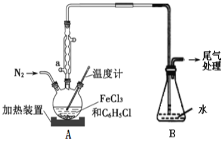
①仪器a的名称是____。
②反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是__,回收滤液中C6H5C1的操作方法是____。
③反应后将锥形瓶中溶液配成250mL,量取25.00mL所配溶液,用0.40mol/LNaOH溶液滴定,终点时消耗NaOH溶液为19.60 mL,则氯化铁的转化率为______。
【答案】H2+2FeCl3![]() 2FeCl2+2HCl BACDCE(或BCDCE) 碱石灰 氯化铁易升华导致导管易堵塞 球形冷凝管 苯 蒸馏滤液,并收集沸点132℃的馏分 78.4%
2FeCl2+2HCl BACDCE(或BCDCE) 碱石灰 氯化铁易升华导致导管易堵塞 球形冷凝管 苯 蒸馏滤液,并收集沸点132℃的馏分 78.4%
【解析】
(1)①H2还原无水FeCl3制取FeCl2,另一产物应为含H、Cl的物质,即为HCl,所以化学方程式为H2+2FeCl3![]() 2FeCl2+2HCl。
2FeCl2+2HCl。
答案为:H2+2FeCl3![]() 2FeCl2+2HCl
2FeCl2+2HCl
②因为FeCl3易吸水,所以在氢气通入前,一定要进行干燥处理,即由B装置制得的H2一定要经过C的干燥处理,至于H2中混有的HCl是否处理,问题并不大,因为通过碱石灰处理水蒸气时,HCl也可被吸收。反应后生成的HCl会污染环境,也需用碱石灰处理,多余的氢气应烧掉,从而得出按气流由左到右的方向,上述仪器的连接顺序为BACDCE(或BCDC)。
答案为:BACDCE(或BCDCE
C中盛放的试剂是碱石灰。答案为:碱石灰
③因为氯化铁易升华,则遇冷会凝华,所以装置的缺陷也就暴露出来,即易堵塞导管。
答案为:氯化铁易升华导致导管易堵塞
(2)①仪器a的名称是球形冷凝管。答案为:球形冷凝管
②因为FeCl2易溶于水、乙醇,所以不能用水、乙醇洗涤;FeCl2难溶于苯,而氯苯、二氯苯易溶于苯,所以可用苯进行洗涤。答案为:苯
因为氯苯和二氯苯的沸点相差较大,所以回收滤液中C6H5C1的操作方法是蒸馏滤液,并收集沸点132℃的馏分。答案为:蒸馏滤液,并收集沸点132℃的馏分
③n(FeCl3)=2n(HCl)=2n(NaOH)= 2×0.40mol/L×0.0196L×10=0.1568mol
氯化铁的转化率为![]()
答案为:78.4%


科目:高中化学 来源: 题型:
【题目】如图是一种综合处理SO2废气的工艺流程.下列说法正确的是( )
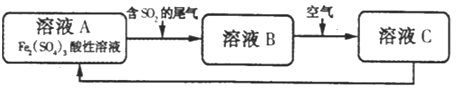
A.向B溶液中滴加KSCN溶液,溶液可能变为血红色
B.溶液B转化为溶液C发生的变化的离子方程式为4H+ + 2Fe2++O2=2Fe3++2H2O,
C.溶液酸性:A>B>C
D.加氧化亚铁可以使溶液C转化为溶液A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是_______。
a.单质的熔点降低
b.原子半径和简单离子半径均减小
c.元素的金属性减弱,非金属性增强
d.氧化物对应的水化物碱性减弱,酸性增强
(2)氧化性最弱的简单阳离子是_______;热稳定性:H2O____H2S(填>、<、=)。
(3)写出SiCl4的电子式:________。
(4)已知化合物M由第三周期的两种相邻元素按原子个数比1:1组成,不稳定,遇水反应生成谈黄色沉淀A和两种无色有刺意性气味气体B、C,相应物质的转化关系如图:

①已知M的摩尔质量为135g/mol,写出M的化学式_____。
②任选一种合适的氧化剂Y,写出C的浓溶液与Y反应生成D的离子反应方程式_______。
③M中的一种元素可形成化合物KXO3,可用于实验室制O2。若不加催化剂,400℃时KXO3分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,加入4molA和 2molB进行如下反应:3A(g)+2B(g)![]() 4C(s)+2D(g)。反应一段时间后达到平衡,测得生成1.6molC,则下列说法正确的是( )
4C(s)+2D(g)。反应一段时间后达到平衡,测得生成1.6molC,则下列说法正确的是( )
A.该反应的化学平衡常数表达式是 K=![]()
B.此时,B的平衡转化率是40%
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.增加 B,平衡向右移动,B的平衡转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制、治理氮氧化物对大气的污染是改善大气质量的重要方法。回答下列与雾霾治理有关的问题:
Ⅰ.(1)在催化剂作用下,甲烷可还原氮氧化物,从而达到治理氮氧化物污染的目的。已知:①CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1;②4NO2(g)+2N2(g)= 8NO(g) ΔH=+586 kJ·mol-1。则CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g) ΔH=________ kJ·mol-1。
(2)工业烟气中的氮氧化物可用NH3催化还原,反应原理如图所示。

其中X为一种无毒的气体,则NH3催化还原氮氧化物的化学方程式为______。
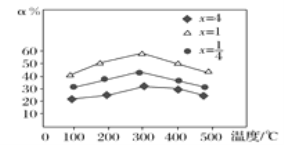
(3)用NH3催化还原烟气中的氮氧化物时,当![]() =x,用Fe作催化剂时,在NH3充足的条件下,不同x值对应的脱氮率α(被还原的氮氧化物的百分率)不同,在不同温度下其关系如图所示,当x=_____时,脱氮效果最佳,最佳的脱氮温度是____ ℃。
=x,用Fe作催化剂时,在NH3充足的条件下,不同x值对应的脱氮率α(被还原的氮氧化物的百分率)不同,在不同温度下其关系如图所示,当x=_____时,脱氮效果最佳,最佳的脱氮温度是____ ℃。
Ⅱ.(4)甲醇是一种绿色燃料,甲醇的工业合成方法较多,如CO(g)+2H2(g)![]() CH3OH(g)。在2 L恒容密闭容器中充入1 mol CO和2 mol H2混合原料气,充分反应达到平衡,测得平衡时混合物中CH3OH的体积分数与压强、温度的关系如图所示。
CH3OH(g)。在2 L恒容密闭容器中充入1 mol CO和2 mol H2混合原料气,充分反应达到平衡,测得平衡时混合物中CH3OH的体积分数与压强、温度的关系如图所示。
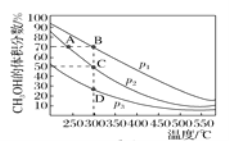
①图中压强p1、p2、p3的大小关系是_______。
②C点平衡常数K=___,A、B、D三点的平衡常数K(分别用KA、KB、KD表示)的大小关系是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化钾是一种无色晶体,易溶于水。实验室制备KI晶体的步骤如下:
Ⅰ.在如下图所示的三颈烧瓶中加入研细的I2和一定量的30%KOH溶液,搅拌(已知:I2与KOH反应产物之一是KIO3);
Ⅱ.碘完全反应后,打开分液漏斗中的活塞、弹簧夹1、2,向装置C中通入足量的H2S;
Ⅲ.反应结束后,向装置C中加入稀H2SO4酸化,水浴加热;
Ⅳ.冷却,过滤得KI粗溶液。
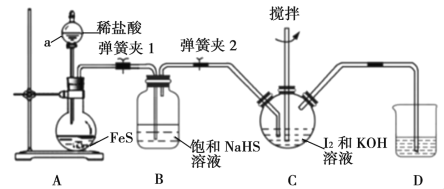
(1)仪器a的名称是__________,步骤Ⅰ中控制KOH溶液过量的目的是______________。
(2)装置B的作用是_____________,装置D中盛放的溶液是________________。
(3)装置C中H2S和KIO3反应的离子方程式为_______________________。
(4)步骤Ⅲ中水浴加热的目的是除去_________________________(填化学式)。
(5)由步骤Ⅳ所得的KI粗溶液中含有少量K2SO4,需进行提纯,提纯流程如下:
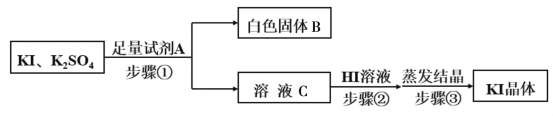
①已知白色固体B是混合物,试剂A为__________,为除去溶液C中的杂质,步骤②中调节溶液为弱酸性,则加入HI溶液后产生的现象是___________________。
②为测定最后所得KI晶体的纯度,取a g晶体配制100mL溶液,取出25mL溶液,滴入足量稀的酸性K2Cr2O7溶液,充分反应后,滴加几滴淀粉溶液为指示剂,用b mol·L-1的Na2S2O3溶液进行滴定,消耗Na2S2O3溶液VmL。
滴定过程中涉及的反应为:![]() ,
,![]() 则滴定终点时的现象为________________________,晶体的纯度为_______________________(列出计算式)。
则滴定终点时的现象为________________________,晶体的纯度为_______________________(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家用氮化镓(GaN)材料与铜作电极组装如图所示的人工光合系统,成功地实现了以CO2和H2O合成CH4。下列说法不正确的是( )
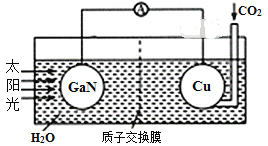
A.电子由GaN沿着导线流向Cu
B.电解液中H+从质子交换膜右侧向左侧迁移
C.GaN表面发生氧化反应,有O2产生
D.Cu表面电极反应式:CO2+8e-+8H+=CH4+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在可逆反应:2A(g)+3B(g)![]() xC(g)+D(g)中,已知:起始浓度A为5mol/L,B为3mol/L,C的反应速率为0.5mol/(L·min),2min后,测得D的浓度为0.5mol/L。则关于此反应的下列说法正确的是( )
xC(g)+D(g)中,已知:起始浓度A为5mol/L,B为3mol/L,C的反应速率为0.5mol/(L·min),2min后,测得D的浓度为0.5mol/L。则关于此反应的下列说法正确的是( )
A. 2min末时A和B的浓度之比为5:3
B. x=1
C. 2min末时B的浓度为1.5mol/L
D. 2min末时A的消耗浓度为0.5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将29.6g碳酸钠和碳酸氢钠的混合物加热到质量不再减少为止,冷却,称得固体质量为26.5g。问:
(1)原固体混合物中碳酸氢钠的质量是多少? ____________
(2)原固体混合物中碳酸钠的物质的量是多少?_____________
(3)把原固体混合物与足量盐酸完全反应生成的CO2在标准状况下的体积是多少?__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com