
| A. | 氟氯烃是一类含氟和氯的卤代烃 | |
| B. | 氟氯烃的化学性质不稳定,有毒 | |
| C. | 氟氯烃大多数无色、无臭、无毒 | |
| D. | 在平流层,氟氯烃在紫外线照射下,分解产生的氯原子可引发损耗O3的循环反应 |
分析 氟氯烃是一类含氟和氯的卤代烃,它化学性质稳定,大多无色、无臭、无毒,所以它被广泛应用于制冷业,但是释放到空气中的氟氯烃,可以到达大气平流层,并且在紫外线作用下,分解产生氯原子,从而引发损耗臭氧的循环反应,造成臭氧层空洞,使大量的紫外线照向大地,伤害地球上的生物,据此分析解答.
解答 解:A.氟氯烃分子中多个氢原子被氟、氯取代得到的产物,故A正确;
B.氟氯烃在紫外线照射下,分解产生氯原子从而引发损耗臭氧的循环反应,造成臭氧层空洞,使大量的紫外线照向大地,伤害地球上的生物,但无毒,故B错误;
C.氟氯烃大多数无色,无臭,无毒,故C正确;
D.在平流层,氟氯烃在紫外线照射下,分解产生氯原子可引发损耗O3的循环反应,故D正确;
故选B.
点评 本题考查了氟氯烃的结构与性质,属于对基础知识的考查,明确氟氯烃能够破坏大气臭氧层是解题关键,注意相关知识的积累.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:选择题
| A. | 3.Omol•L-1 | B. | 2.Omol•L-1 | C. | O.3mol•L-1 | D. | O.2mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏水 | B. | 糖水 | C. | 水银 | D. | 水晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
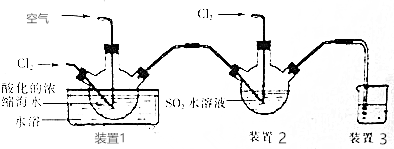
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 温度 实验次数 | 起始温度t1/℃ | 终止温度t℃/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | 4.0 |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
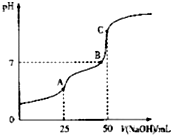 25°C时,向25ml 0.1wol•L-1 H2C2O4溶液中滴加同浓度的NaOH溶液,混合溶液的pH随滴加NaOH溶液体积的变化如图所示.下列有关叙述错误的是( )
25°C时,向25ml 0.1wol•L-1 H2C2O4溶液中滴加同浓度的NaOH溶液,混合溶液的pH随滴加NaOH溶液体积的变化如图所示.下列有关叙述错误的是( )| A. | HC2O4-的电离程度大于其水解程度 | |
| B. | B点时溶液中含有NaHC2O4和Na2C2O4 | |
| C. | A点时,c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-) | |
| D. | C点时,c(Na+)>c(C2O42-)>c(HC2O4-)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com