
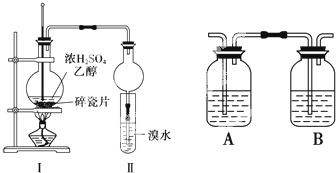
 某化学兴趣小组用如图所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性.
某化学兴趣小组用如图所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性.分析 (1)实验室制备乙烯所用的原料为乙醇,浓硫酸作催化剂、脱水剂,反应条件是加热到170℃;
(2)浓H2SO4具有强氧化性,能将乙醇氧化成碳,根据SO2具有还原性,也能与溴水反应使溴水褪色,据此即可解答;
(3)溴水中的溴与乙烯发生加成反应;
(4)在Ⅰ和Ⅱ之间增加图2装置,A装置是为了除去SO2和CO2,B装置是为了检验SO2是否除尽.
解答 解:(1)利用乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,乙醇发生了消去反应,CH3CH2OH$→_{170℃}^{浓硫酸}$ CH2=CH2↑+H2O;
故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$ CH2=CH2↑+H2O;
(2)浓H2SO4具有强氧化性,将乙醇氧化成碳,并且可以进一步反应,C+2H2SO4 $\frac{\underline{\;加热\;}}{\;}$CO2↑+2SO2↑+2H2O,SO2具有还原性,可以与Br2反应,SO2+Br2+2H2O=2HBr+H2SO4,所以BC正确,
故答案为:BC;
(3)溴水中的溴与乙烯发生加成反应,即CH2=CH2+Br2→CH2BrCH2Br,1,2-二溴乙烷在试管底层为油状物质,
故答案为:试管底层有油状物质生成;
(4)A装置是为了除去SO2,可用NaOH溶液,B装置是为了检验SO2是否除尽,可用品红溶液,
故答案为:氢氧化钠溶液;品红;检验SO2是否除尽.
点评 本题考查了实验室制取乙烯实验,明确实验原理是解本题关键,根据浓硫酸、乙烯的性质来分析解答,注意二氧化硫、乙烯都能使溴水褪色,但褪色原理不同,乙烯使溴水褪色是发生了加成反应,二氧化硫使溴水褪色是发生了氧化还原反应.


科目:高中化学 来源: 题型:选择题
| A. | 它只有一种氧化物Cs2O | B. | 它与水剧烈反应 | ||
| C. | Cs+具有很强的氧化性 | D. | CsHCO3受热不易分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、F-、Cl- | B. | Mg2+、SO42-、Br- | C. | Mg2+、Cl-、Fe2+ | D. | Na+、NH4+、Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某校化学兴趣小组的同学对硝酸盐的受热分解进行探究.他们设计了如图装置分别加热了NaNO3、Cu(NO3)2、AgNO3.(加热及夹持装置未画出)
某校化学兴趣小组的同学对硝酸盐的受热分解进行探究.他们设计了如图装置分别加热了NaNO3、Cu(NO3)2、AgNO3.(加热及夹持装置未画出)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.
溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
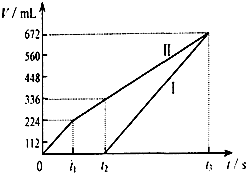 电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如下图所示(气体体积已换算成标准状况下的体积),根据图中信息回答下列问题.
电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如下图所示(气体体积已换算成标准状况下的体积),根据图中信息回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 明矾和漂白粉均可用于自来水的杀菌、消毒 | |
| B. | 新制的0.1mol/L氯水中加入少量的CaCO3固体,HClO的物质的量浓度减小 | |
| C. | Na2O和Na2O2都能与H2O反应,其反应原理不相同 | |
| D. | O3、H2O2、SO2、Na2O2均有漂白性,其原理不尽相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲认为上述发现绝对不可能,因为H3分子违背了共价键理论 | |
| B. | 丁认为如果上述的发现存在,则证明传统的价键理论并不完善 | |
| C. | 丙认为H3分子实质上是H2分子与H+以特殊共价键结合的产物,应写成H3+ | |
| D. | 乙认为宇宙中还可能存在另一种氢单质,因为氢元素有三种同位素必然有三种同素异形体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com