
| 嫦娥一号 | 液氢(H2) | ①2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1 ②2H2(l)+O2(l)=2H2O(g)△H=-482.6kJ•mol-1 |
| 祥云火炬 | 丙烷 (C3H8) | ③C3H8(l)+5O2(g)=3CO2(g)+4H2O(g)△H=-2013.8kJ•mol-1 ④C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2221.5kJ•mol-1 |
分析 (1)1mol可燃物完全燃烧生成稳定氧化物放出的热量为燃烧热,结合热化学方程式分析判断和计算燃烧热进行判断;
(2)根据燃烧热值高低结合产物有无污染环境判断.
解答 解:(1)由①2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1 ,热化学方程式是2mol氢气燃烧生成稳定氧化物的反应,则氢气的燃烧热是$\frac{571.6KJ/mol}{2}$=285.8kJ•mol-1,
②2H2(l)+O2(l)=2H2O(g)△H=-482.6kJ•mol-1,热化学方程式生成的是气体水,不是稳定氧化物,不能据此计算;
③C3H8(l)+5O2(g)=3CO2(g)+4H2O(g)△H=-2013.8kJ•mol-1,反应生成的水是气体,不是稳定氧化物,不能据此计算;
④C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2221.5kJ•mol-1,是1mol丙烷完全燃烧生成稳定氧化物放热为燃烧热即为2221.5kJ•mol-1;
故答案为:285.8 kJ•mol-1;2221.5 kJ•mol-1;
(2)根据(1)得出氢气的燃烧热是285.8kJ•mol-1,则氢气的燃烧热值为$\frac{285.8}{2}$=142.9KJ/g,丙烷燃烧热为2221.5kJ•mol-1,则丙烷燃烧热值为$\frac{2221.5}{44}$=50.49KJ/g,所以氢气作为燃料的主要优点是燃烧热值高,燃烧产物不污染环境,
故答案为:燃烧热值高,燃烧产物不污染环境.
点评 本题考查了燃烧热概念的分析理解和热化学方程式的判断应用,把握概念是解题关键,题目较简单.


科目:高中化学 来源: 题型:选择题
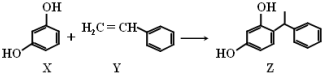
| A. | X、Y和Z均能使溴水褪色 | |
| B. | X和Z均能与Na2CO3溶液反应 | |
| C. | Y分子中所有原子可能在同一平面上 | |
| D. | Z能发生加成反应、取代反应,但不能发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6:3:2 | B. | 3:2:1 | C. | 1:2:3 | D. | 1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
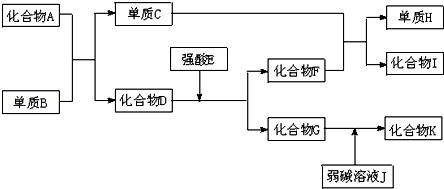
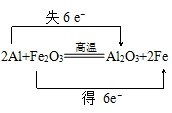 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2通入饱和Na2CO3溶液中 | B. | SO2通入Ca(ClO)2溶液中 | ||
| C. | NH3通入HNO3和AgNO3的混和溶液中 | D. | CO2通入BaCl2溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | 密度/g•cm-3 | 沸点/℃ | 溶解性 |
| 正丁醇 | 0.810 | 118.0 | 可溶 |
| 冰醋酸 | 1.049 | 118.1 | 互溶 |
| 乙酸正丁酯 | 0.882 | 126.1 | 微溶 |
| 乙醇 | 0.79 | 78.5 | 互溶 |
| 乙酸乙酯 | 0.88 | 77.06 | 可溶 |
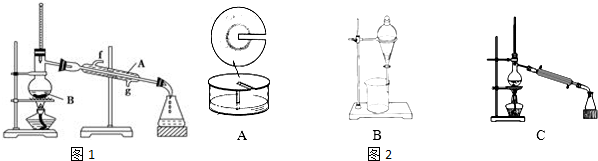
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com