
分析 (1)依据热化学方程式 和盖斯定律计算得到;因为△H<0,△S<0,所以该反应在常压和70~120℃条件下就能自发反应;
(2)①化学平衡常数等于平衡时生成物的浓度幂之积比上反应物浓度幂之积;
②平衡时原来变化的量,现在不变说明反应达平衡状态;
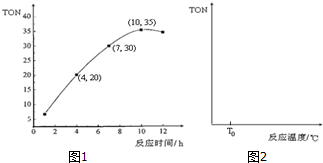
③由图可知10h时TON的值最大,v=$\frac{△c}{△t}$计算求解;
④如果在其它条件不变的情况下,投入反应物开始,反应温度越高反应速率越快,甲醇转化数(TON)增大,当达到一定温度时达平衡状态,此时甲醇转化数(TON)最大,然后再改变温度平衡移动,由此分析解答;
⑤要达到平衡时下列措施能提高TON值,所以改变条件使平衡正向移动,由此分析.
解答 解:(1)ⅰCO的标准燃烧热:-283.0kJ•mol-1,所以CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1 ①,
ⅱ1mol H2O(l)完全蒸发变成H2O(g)需吸收44kJ的热量,所以H2O(l)=H2O(g)△H=+44kJ•mol-1 ②,
ⅲ,2CH3OH(g)+CO2 (g)?CH3OCOOCH3 (g)+H2O(g)△H=-15.5kJ•mol-1 ③;
则2CH3OH(g)+CO(g)+1/2O2(g)?CH3OCOOCH3 (g)+H2O(l)△H=①-②+③=-283.0kJ•mol-1-44kJ•mol-1-15.5kJ•mol-1=-342.5kJ•mol-1,因为△H<0,△S<0,所以该反应在常压和70~120℃条件下就能自发反应,故答案为:-342.5kJ•mol-1;因为该反应△H<0,△S<0;
(2)①化学平衡常数等于平衡时生成物的浓度幂之积比上反应物浓度幂之积,K=$\frac{c(C{H}_{3}OCOOC{H}_{3})c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)c(C{O}_{2})}$,故答案为:K=$\frac{c(C{H}_{3}OCOOC{H}_{3})c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)c(C{O}_{2})}$;
②A.v正(CH3OH)=2v正(CO2)=2v逆(CO2),达平衡状态,故正确;
B.平衡时CH3OCOOCH3与H2O的物质的量之比可能保持不变,也可能变化,故错误;
C.容器内气体的密度始终不变,故错误;
D.容器内压强不变,说明各物质的量不变,达平衡状态,故正确;
故选:AD;
③由图可知10h时TON的值最大,4~10h内转化的甲醇的物质的量为6×10-5mol×(35-20)=90×10-5mol,所以转化的DMC的物质的量为$\frac{90×1{0}^{-5}mol}{2}$=45×10-5mol,则v=$\frac{△c}{△t}$=$\frac{\frac{45×1{0}^{-5}}{0.1}}{10-4}$=7.5×10-4mol•L-1•h-1,故答案为:10;7.5×10-4mol•L-1•h-1;
④如果在其它条件不变的情况下,投入反应物开始,反应温度越高反应速率越快,甲醇转化数(TON)增大,当达到一定温度时达平衡状态,此时甲醇转化数(TON)最大,然后再改变温度平衡移动,正反应是放热反应,所以升高温度平衡逆向移动,甲醇转化数(TON)减小,所以图象为: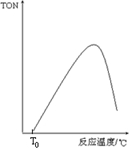 ,故答案为:
,故答案为: ;
;
⑤要达到平衡时下列措施能提高TON值,所以改变条件使平衡正向移动,
A.往反应体系中添加催化剂,平衡不移动,故不选;
B.往反应体系中添加吸水剂,生成物浓度减少,平衡正向移动,故选;
C.从反应体系中分离出CO2,减少反应物浓度平衡逆向移动,故不选;
D.扩大容器的体积,相当于减少压强,平衡逆向移动,故不选; 故选:B.
点评 本题考查盖斯定律、反应的自发性、化学平衡常数和平衡的移动,综合性强,特别化学反应速率的计算有一定的难度.


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{100w}{w+18a}$% | B. | $\frac{7100w}{161(w+18a)}$% | C. | $\frac{100w}{w+36a}$% | D. | $\frac{7100w}{161(w+36a)}$% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一氧化碳的转化率提高,水蒸气的转化率降低 | |
| B. | 反应物的转化率都提高 | |
| C. | 平衡向正反应方向移动,达到新的平衡时二氧化碳的体积分数增大 | |
| D. | 平衡向正反应方向移动,二氧化碳的物质的量将大于1 mol但小于2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L1mol/L的碳酸钠溶液中含CO32-NA个 | |
| B. | 标准状况下,11.2L甲醇与足量钠反应,可生成标准状况下氢气5.6L | |
| C. | H2O2和H2O的混合物1mol中,含阴离子个数为NA | |
| D. | 标准状况下,22.4LCl2与足量铁充分反应,电子转移数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在一定条件,可逆反应:mA+nB?pC达到平衡状态.
在一定条件,可逆反应:mA+nB?pC达到平衡状态.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 序号 | ① | ② | ③ | ④ | ⑤ |
| 溶液 | NaCl | CH3COONH4 | NaClO | NaHCO3 | Na2CO3 |
| pH | 7.0 | 7.0 | 10.3 | 8.3 | 11.6 |
| A. | 酸性的相对强弱:HClO>HCO3- | |
| B. | 由水电离产生的c(H+):①=② | |
| C. | 溶液③④中酸根离子浓度:c(ClO-)>c(HCO3-) | |
| D. | 在④⑤溶液等体积混合后的溶液中:c(HCO3-)+c(CO32-)+c(H2CO3)=0.1 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com