
(18分).某同学需要用到85 mL 1 mol/L的NaCl溶液,现需在实验进行配制,填空并请回答下列问题:
(1)配制1 mol/L的NaCl溶液
| 托盘天平称取NaCl的质量 | 应选用容量瓶的规格(可供选择的规格100 mL、250 mL、500 mL) | 除容量瓶外还需要的其它仪器 |
| | | |
科目:高中化学 来源: 题型:
(12分)影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如下表:
| 实 验 步 骤 | 现 象 | 结 论 |
| ①分别取等体积的2 mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg。 | 反应快慢: Mg>Fe>Cu | 反应物的性质越活泼,反应速率越快。 |
(1)该同学的实验目的是________________________________;
要得出正确的实验结论,还需控制的实验条件是________。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用下图装置进行定量实验。完成该实验应选用的实验药品是______;
应该测定的实验数据是____________________________。
实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是__________________的影响。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是____
A、硫酸钾 B、硫酸锰 C、氯化锰 D、水
查看答案和解析>>
科目:高中化学 来源:2010-2011学年辽宁省师大附中高一下学期期中考试化学试卷 题型:实验题
(12分)影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如下表:
| 实 验 步 骤 | 现 象 | 结 论 |
| ①分别取等体积的2 mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg。 | 反应快慢: Mg>Fe>Cu | 反应物的性质越活泼,反应 速率越快。 速率越快。 |

 O4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
O4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。| A.硫酸钾 | B.硫酸锰 | C.氯化锰 | D.水 |
查看答案和解析>>
科目:高中化学 来源:2013届辽宁省高一下学期期中考试化学试卷 题型:实验题
(12分)影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如下表:
|
实 验 步 骤 |
现 象 |
结 论 |
|
①分别取等体积的2 mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg。 |
反应快慢: Mg>Fe>Cu |
反应物的性质越活泼,反应速率越快。 |
(1)该同学的实验目的是________________________________;
要得出正确的实验结论,还需控制的实验条件是________。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用下图装置进行定量实验。完成该实验应选用的实验药品是______;

应该测定的实验数据是____________________________。
实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是__________________的影响。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是____
A、硫酸钾 B、硫酸锰 C、氯化锰 D、水
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有某兴趣小组研究浓硫酸的氧化性的结论并进行了实验验证:
①一般认为1:1的硫酸浓度大于60%,就具有一定的氧化性,越浓氧化性越强,60%以下的H2SO4氧化性就不怎么强了。
②温度也影响氧化性,如铜放于冷的浓硫酸中反应不明显,如果加热就可以观察到明显现象。
③98%的浓硫酸物质的量浓度为18.4mol?L-1,密度为1.84g?cm-3
据以上信息回答:
(1)如图装置,同学甲先向带支管的试管中放入铜粉和3mL水,然后从分液漏斗中加98%的浓硫酸10―15滴(约0.5mL),加热至沸腾,该试管中液体是否有明显变化 。(填“是”或“否”)
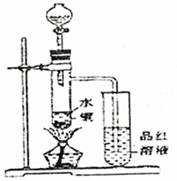
(2)甲同学再用分液漏斗加浓硫酸10mL后加热至沸腾,现象是 。
(3)乙同学利用所示装置直接从分液漏斗中加浓硫酸10mL与铜片反应。所观察到与甲不同的现象是 。为了最终看到与甲类似的现象,乙同学需进行的操作是: 。
(4)乙同学进行加热,还在带支管的试管中观察到有黑色物质出现,大胆假设此物质是
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com