
| A. | 1mol/L或5mol/L | B. | 3mol/L或5mol/L | C. | 1mol/L或3mol/L | D. | 3mol/L或7mol/L |
分析 根据Al2(SO4)3溶液与KOH溶液的反应计算分析,20mL1mol/LAl2(SO4)3全转化为沉淀的质量为:0.02L×2mol/L×78g/mol=3.12g,根据Al3++3OH-=Al(OH)3↓和Al(OH)3+OH-=AlO2-+H2O,可知KOH存在两种情况,一是不足,二是使Al(OH)3部分溶解,以此进行计算.
解答 解:20mL1mol/LAl2(SO4)3完全转化为沉淀的质量为:0.02L×2mol/L×78g/mol=3.12g,
根据Al3++3OH-=Al(OH)3↓和Al(OH)3+OH-=AlO2-+H2O,可知存在两种情况,一是不足,二是使Al(OH)3部分溶解,
设KOH的浓度为c,当KOH不足时,
Al3++3OH-=Al(OH)3↓
3mol 78g
0.03L×c 0.78g
则:c=$\frac{3mol×0.78g}{0.03L×78g}$=1mol/L,
当KOH使Al(OH)3部分溶解时,设KOH的物质的量为x,根据反应:
Al3++3OH-=Al(OH)3↓
1mol 3mol 78g
0.04mol 0.12mol 3.12g
Al(OH)3+OH-=AlO2-+H2O
78g 1mol
(3.12-0.78)g (x-0.12mol)
x=0.15mol,
则KOH的物质的量浓度为:c=$\frac{n}{V}$=$\frac{0.15mol}{0.03L}$=5mol/L,
由上述分析计算可知,KOH溶液的物质的量浓度为1mol/L或5mol/L,
故选A.
点评 本题考查物质的量浓度的计算,题目难度中等,明确反应后产物组成为解答关键,注意掌握讨论法在化学计算中的应用,试题培养了学生的化学计算能力.


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:解答题
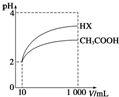 25℃时,部分物质的电离平衡常数如表所示:
25℃时,部分物质的电离平衡常数如表所示:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
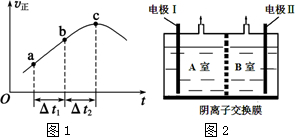
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
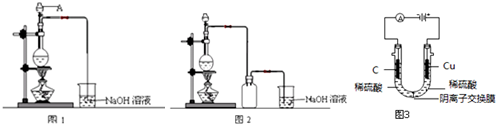
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3和NaOH溶液反应:Al2O3+2OH-═2AlO2-+H2↑ | |
| B. | NaHCO3溶液与NaOH溶液反应:OH-+HCO3-═CO2↑+H2O | |
| C. | Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| D. | AlCl3溶液中加入足量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
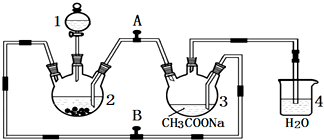
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的最高价氧化物对应水化物的酸性比W的强 | |
| B. | W的气态氢化物比X的稳定 | |
| C. | 离子半径的大小顺序:r(W)>r(X)>r(Y)>r(Z) | |
| D. | WX2与ZY2中的化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 结论 |
| 在“褐变”后的苹果上滴上2~3滴 KSCN溶液. | 无红色出现 | 说法A不正确 |
| 序号 | 实验步骤 | 现 象 | 结 论 |
| ① | 在一块上滴加2~3滴FeCl3溶液 | 表面变为绿色 | 对苯二酚 |
| ② | 再取两块,一块放置于空气中,另一块迅速浸入经过去氧的蒸馏水中. | 前者表面逐渐褐变,后者相当长一段时间内,无明显变化. | 苹果褐变与氧气有关 |
| ③ | 另两块分别立刻放入沸水和0.1mol•L-1盐酸中浸泡2min后取出,置于空气中. | 相当长一段时间内,两块均无明显变化. | 苹果褐变与酚氧化酶的活性有关 |
| ④ | 最后两块分别立刻放入浓度均为0.1mol•L-1的NaHCO3和Na2SO3溶液里浸泡2min后取出,置于空气中. | 前者经过一段时间表面逐渐褐变,后者相当长一段时间内,无明显变化. | 亚硫酸钠溶液能阻止苹果褐变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com