
【题目】根据地球化学分析,地壳中存在量较大的9种元素含量如图所示,含量第一、第三、第四的三种元素用字母代号表示。回答下列问题:
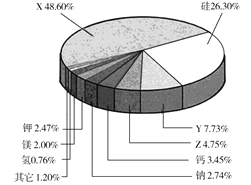
(1)X的名称为 _________,Z的元素符号为 _______ 。
(2)硅的氧化物与氢氟酸反应的化学方程为________,Y元素的单质与Z3X4反应的化学方程式为 ___________,23.2 g Z3X4完全反应时,转移的电子数目为__________。(用NA代表阿伏加德罗常数的值)
(3)NOx的消除。汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可发生如下反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) ΔH。
N2(g)+2CO2(g) ΔH。
已知:CO燃烧热的ΔH1=-283.0kJ·mol-1,N2(g)+O2(g) ![]() 2NO(g) ΔH2=+180.5kJ·mol-1,则ΔH=___________。
2NO(g) ΔH2=+180.5kJ·mol-1,则ΔH=___________。
(4)以MnSO4溶液为原料可通过电解法制备超级电容材料MnO2,其装置如图所示:
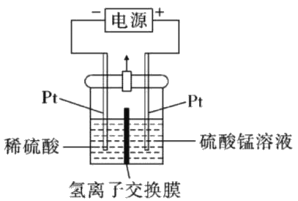
①则电解过程中阳极电极反应为_________。
②电解一段时间后,阴极溶液中H+的物质的量____________(填“变大”、“减小”或者“不变”)。
【答案】氧 Fe SiO2 + 4HF = SiF4↑ + 2H2O 8Al+3Fe3O4![]() 4Al2O3+9Fe 0.8NA -746.5KJ/mol Mn2+-2e-+2H2O=MnO2+4H+ 不变
4Al2O3+9Fe 0.8NA -746.5KJ/mol Mn2+-2e-+2H2O=MnO2+4H+ 不变
【解析】
(1)地壳中元素含量由多到少分别为氧、硅、铝、铁、钙、钠、钾、镁、氢;
(2)硅的氧化物与氢氟酸反应生成四氟化硅气体和水;Al与Fe3O4发生铝热反应;
(3)根据盖斯定律解题;
(4)根据阳极氧化失电子,阴极还原得电子书写电极反应,判断离子物质的量的变化;
(1)地壳中元素含量由多到少分别为氧、硅、铝、铁、钙、钠、钾、镁、氢;X地壳中含量最高,名称为氧,Z在地壳中含量位于第四位,元素符号为Fe;
答案:氧 Fe
(2)硅的氧化物与氢氟酸反应生成四氟化硅和水,化学方程式为SiO2 + 4HF = SiF4↑ + 2H2O,Al与Fe3O4发生铝热反应生成Al2O3和Fe,反应的化学方程式为8Al+3Fe3O4![]() 4Al2O3+9Fe,23.2 g Fe3O4完全反应时转移的电子数目为
4Al2O3+9Fe,23.2 g Fe3O4完全反应时转移的电子数目为![]() =0.8NA;
=0.8NA;
答案:SiO2 + 4HF = SiF4↑ + 2H2O 8Al+3Fe3O4![]() 4Al2O3+9Fe 0.8NA
4Al2O3+9Fe 0.8NA
(3)已知:CO燃烧热的ΔH1=-283.0kJ·mol-1,热化学方程式为2CO(g)+O2(g)=2CO2(g)ΔH1=-576kJ·mol-1①,N2(g)+O2(g) ![]() 2NO(g) ΔH2=+180.5kJ·mol-1②,根据盖斯定律①-②得2NO(g)+2CO(g)
2NO(g) ΔH2=+180.5kJ·mol-1②,根据盖斯定律①-②得2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) ΔH=-746.5KJ/mol;
N2(g)+2CO2(g) ΔH=-746.5KJ/mol;
答案:-746.5KJ/mol
(4)①根据Mn的化合价,从+2价→+4价,失电子发生氧化反应,则阳极电极反应式为Mn2+-2e-+2H2O=MnO2+4H+;
②阴极上2H++2e-=H2,若电解过程中外电路转移amole-,则阴极消耗amolH+,同时有amolH+由阳极移向阴极,故阴极溶液中H+的物质的量不会改变;
答案:Mn2+-2e-+2H2O=MnO2+4H+ 不变


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
【题目】一定温度下(T2> Tl),在3个体积均为2.0 L的恒容密闭容器中反应 2NO(g)+ Cl2(g) = 2ClNO(g)(正反应放热)达到平衡,下列说法正确的是

A. 达到平衡时,容器I与容器II中的总压强之比为1:2
B. 达到平衡时,容器III中ClNO的转化率小于80%
C. 达到平衡时,容器II中c(ClNO(/ c(NO)比容器I中的大
D. 若温度为Tl,起始时向同体积恒容密闭容器中充入0.20 mol NO(g)、0.2 mol Cl2(g)和0.20 mol ClNO(g),则该反应向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酒石酸托特罗定主要用于治疗泌尿系统疾病。工业合成该药物的中间体(F)的路线如下:
回答下列问题:
(1)D分子中的含氧官能团名称为 __________;B→C包含两步反应,反应类型分别为_______、_______;
(2)A的结构简式为________;
(3)写出苯甲醛与银氨溶液反应的化学方程式 _______;
(4)写出同时满足下列条件的B的一种同分异构体的结构简式:_____________;
①能使溴的CCl4溶液褪色;②能与FeCl3溶液发生显色反应;③苯环上的一氯代物有一种;④分子中有4种不同化学环境的氢。
(5)已知呋喃丙胺(![]() CH=CHCON(CH3)2 )是一种高效麻醉剂,写出以
CH=CHCON(CH3)2 )是一种高效麻醉剂,写出以![]() 、CH3CHO、NH(CH3)2为原料制备呋喃丙胺的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_________________。
、CH3CHO、NH(CH3)2为原料制备呋喃丙胺的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A. 向四羟基合铝酸钠溶液中滴加过量的碳酸氢钠溶液:[Al(OH)4]—+4H+=Al3++2H2O
B. 将少量SO2气体通入足量的NaClO溶液中:SO2+2ClO-+H2O=SO32-+2HClO
C. NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH—=BaSO4↓+2H2O
D. 向沸水中滴加饱和氯化铁溶液:Fe3++3H2O=Fe(OH)3↓+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】复旦大学王永刚的研究团队制得一种柔性水系锌电池,该可充电电池以锌盐溶液作为电解液,其原理如图所示。下列说法不正确的是
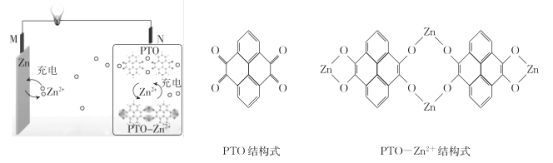
A.放电时,N极发生还原反应
B.充电时,Zn2+向M极移动
C.放电时,每生成1 mol PTO- Zn2+ ,M极溶解Zn的质量为260 g
D.充电时,N极的电极反应式为2PTO+8e- +4Zn2+=PTO- Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气与适量氯气混合反应可生成NH4Cl(俗称脑砂)和一种无污染的气体。某学习小组利用下列装置模拟该反应,请回答相关问题。

(1)该实验中所需的氯气是用浓盐酸与MnO2反应制取。装置A中仪器X的名称为____;X中发生反应的离子方程式为_______。
(2)要得到干燥纯净的氯气,上述A、B、C装置的连接顺序依次为a→_____(用小写字母表示)。
(3)利用E装置,将适量氨气与氯气充分混合反应氨气应从_______(用小写字母表示)通入,反应的化学方程式为_______________;可能观察到的现象是___________。
(4)《唐本草》记载脑砂入药可以散瘀消肿,天然脑砂含少量NH4Cl,现取天然脑砂进行NH4Cl含量测定。准确称取一定质量脑砂,与足量的氧化铜混合,如下图所示进行实验。已知:2NH4Cl+3CuO=3Cu+N2+2HCl+3H2O 。
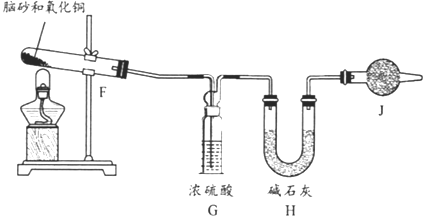
①为顺利完成有关物理量的测定,请完善下列表格:
测量时间点 | 加热前 | 当观察到_____现象时 |
测量内容 | _______________ | 停止加热,冷却,称量H装置的总质量 |
②如果不用J装置,测出NH4Cl的含量将_____(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可由N物质通过以下路线合成天然橡胶和香料柑青酸甲酯衍生物F。

已知:

(1)用系统命名法对N命名________.
(2)①试剂a的名称是________。②C→D中反应i的反应类型是________。
(3)E的结构简式是_____________。
(4)关于试剂b的下列说法不正确是________(填字母序号)。
a. 存在顺反异构体 b. 难溶于水c. 能发生取代、加成和氧化反应 d. 不能与NaOH溶液发生反应
(5)写出A生成B的反应方程式_________。
(6)分子中含有![]() 结构的D的所有同分异构共有________种(含顺反异构体),写出其中任意一种含反式结构的结构简式________。
结构的D的所有同分异构共有________种(含顺反异构体),写出其中任意一种含反式结构的结构简式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25 ℃时,制备亚硝酰氯所涉及的热化学方程式和平衡常数如表:
热化学方程式 | 平衡常数 | |
① | 2NO2(g)+NaCl(s) | K1 |
② | 4NO2(g)+2NaCl(s) | K2 |
③ | 2NO(g)+Cl2(g) | K3 |
则该温度下,ΔH3=_______________kJmol-1;K3=_____________(用K1和K2表示)。
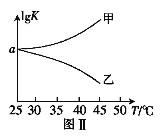
(2)25℃时,在体积为2L的恒容密闭容器中通入0.08 mol NO和0.04 molCl2发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图Ⅰ实线所示,则ΔH3 ___(填“>”“<”或“=”)0;若其他条件相同,仅改变某一条件,测得其压强随时间的变化如图Ⅰ虚线所示,则改变的条件是_____________;在5 min时,再充入0.08 mol NO和0.04 molCl2,则混合气体的平均相对分子质量将_____________(填“增大”、“减小”或“不变”)。图Ⅱ是甲、乙两同学描绘上述反应③的平衡常数的对数值(lgK)与温度的变化关系图,其中正确的曲线是______(填“甲”或“乙”),a值为__________。25 ℃时测得反应③在某时刻,NO(g)、Cl2(g)、NOCl(g)的浓度分别为0.8、0.1、0.3,则此时v正_________v逆(填“>”“<”或“=”)

(3)在300 ℃、8 MPa下,将CO2和H2按物质的量之比1∶3 通入一密闭容器中发生CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
CH3OH(g)+H2O(g)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F为元素周期表中前四周期元素,且原子序数依次增大,A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C的氧化物是导致酸雨的主要物质之一,D原子核外电子有8种不同的运动状态,E的基态原子在前四周期元素的基态原子中单电子数最多,F元素的基态原子最外能层只有一个电子,其他能层均已充满电子。
(1)写出基态E原子的价电子排布式_______。
(2)A与C可形成CA3分子,该分子中C原子的杂化类型为______,该分子的立体结构为_____;C的单质与BD化合物是等电子体,据等电子体的原理,写出BD化合物的电子式______;A2D由液态形成晶体时密度减小,其主要原因是__________(用文字叙述)。
(3)已知D、F能形成一种化合物,其晶胞的结构如图所示,则该化合物的化学式为___;若相邻D原子和F原子间的距离为a cm,阿伏加德罗常数的值为![]() NA,则该晶体的密度为______g·cm-3(用含a、NA的式子表示)。
NA,则该晶体的密度为______g·cm-3(用含a、NA的式子表示)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com