
 ;用电子式表示D元素和G元素形成化合物的过程:
;用电子式表示D元素和G元素形成化合物的过程: .
.分析 A元素的最高正化合价和最低负化合价的代数和等于0,且A是形成化合物种类最多的元素,故A是碳元素;
C原子能形成分别含10电子、18电子的两种阴离子,故C为氧元素,能形成氧离子和过氧根离子,分别为10电子和18电子;
A、B、C原子序数依次递增,故B为氮元素;
C与F位于同一主族,那么F为硫元素;
G也为短周期元素,故G应为氯元素;
E的简单阳离子是同周期元素所形成的简单离子中半径最小的,故E为铝元素;
D单质投入冷水中反应缓慢,投入沸水中迅速产生气泡,且D原子序数小于Al,故D为镁元素,
(1)B为N,据此解答;
(2)CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子;氯化镁为离子化合物,据此书写;
(3)依据题意推断M为Si;
(4)利用强酸能够制取弱酸书写反应方程式证明即可;
(5)非金属性越强,其最高价氧化物对应水合物酸性越强;
(6)比较元素的金属性强弱,可根据金属与水、酸反应的剧烈程度以及对应的最高价氧化物的水化物的碱性强弱判断,以此解答该题.
解答 解:A元素的最高正化合价和最低负化合价的代数和等于0,且A是形成化合物种类最多的元素,故A是碳元素;
C原子能形成分别含10电子、18电子的两种阴离子,故C为氧元素,能形成氧离子和过氧根离子,分别为10电子和18电子;
A、B、C原子序数依次递增,故B为氮元素;
C与F位于同一主族,那么F为硫元素;
G也为短周期元素,故G应为氯元素;
E的简单阳离子是同周期元素所形成的简单离子中半径最小的,故E为铝元素;
D单质投入冷水中反应缓慢,投入沸水中迅速产生气泡,且D原子序数小于Al,故D为镁元素,
(1)B为氮元素,处于第二周期第VA族,故答案为:二;ⅤA;
(2)CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,其电子式为 ,MgCl2为离子化合物,用电子式表示的形成过程为
,MgCl2为离子化合物,用电子式表示的形成过程为 ,
,
故答案为: ;
; ;
;
(3)元素M位于Al与S元素之间,且M单质是优良的半导体材料,广泛用于太阳能电池,故M为硅元素,元素的非金属性越强,其气态氢化物越稳定,由于非金属性Cl>S>Si,故氢化物稳定性:HCl>H2S>SiH4,故答案为:HCl>H2S>SiH4;
(4)硝酸酸性强于碳酸,故硝酸与碳酸钠反应放出二氧化碳气体,化学反应方程式为:Na2CO3+2HNO3═2NaNO3+CO2↑+H2O,碳酸酸性强于硅酸,故碳酸与硅酸钠反应生成难溶于水的硅酸,化学反应方程式为:Na2SiO3+H2O+CO2═H2SiO3↓+Na2CO3,
故答案为:Na2CO3+2HNO3═2NaNO3+CO2↑+H2O;Na2SiO3+H2O+CO2═H2SiO3↓+Na2CO3;
(5)由于非金属性Cl>S>C>Si,故酸性:HClO4>H2SO4>H2CO3>H2SiO3,故答案为:HClO4>H2SO4>H2CO3>H2SiO3;
(6)A、两者均为排在H之前的活泼金属,金属性强的与稀硫酸反应放出氢气快,故A正确;
B、铝为两性单质,能与氢氧化钠反应放出氢气,镁不能与氢氧化钠副反应放出氢气,此不能说明金属活泼性,故B错误;
C、Mg和Al均不是变价元素,故与氧气、氯气、硫反应产物均只有一种,不能说明金属活泼性,故C错误,
故选A.
点评 本题以元素的推断为载体,主要考查的是金属性与非金属性强弱比较、电子式的书写、元素所在周期表位置的判断等,综合性较强,难度一般.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
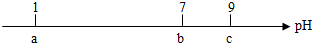
| A. | 常温下,0.1mol•L-1的HCl溶液的pH=1 | |
| B. | 当pH=7时,所加NH3•H2O溶液的体积大于10mL | |
| C. | 当7<pH<9时,溶液中c(NH4+)>c(Cl-) | |
| D. | 继续滴加0.1mol•L-1的NH3•H2O溶液,溶液的pH最终可以变化至13 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体中一定有甲烷 | B. | 混合气体中一定是甲烷和乙烯 | ||
| C. | 混合气体中一定有乙烯 | D. | 混合气体中一定有乙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 给容器消毒 | B. | 杀死果实周围的细菌,防止霉变 | ||
| C. | 延长果实或花朵的寿命 | D. | 催熟果实或花朵 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
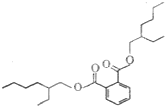 塑化剂是工业上被广泛使用的高分子材料添加剂,食用后对人体有害,其结构式如图.下列有关塑化剂的说法正确的是( )
塑化剂是工业上被广泛使用的高分子材料添加剂,食用后对人体有害,其结构式如图.下列有关塑化剂的说法正确的是( )| A. | 易溶于水,其水溶液有丁达尔效应 | B. | 在稀硫酸中不能稳定存在 | ||
| C. | 不能发生还原反应 | D. | 不能发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,可以证明该结论的实验是(用离子方程式表示)Cl2+S2-═2Cl-+S↓
,可以证明该结论的实验是(用离子方程式表示)Cl2+S2-═2Cl-+S↓查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一种锌锰干电池外壳的纸层包装印有如图所示的文字,其电极分别为碳棒和锌皮,以糊状NH4Cl和ZnCl2作电解质(其中加人MnO2氧化吸收H2)
一种锌锰干电池外壳的纸层包装印有如图所示的文字,其电极分别为碳棒和锌皮,以糊状NH4Cl和ZnCl2作电解质(其中加人MnO2氧化吸收H2)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的液化是物理变化 | |
| B. | 石油干馏可得到汽油、煤油等 | |
| C. | 淀粉、蛋白质完全水解的产物互为同分异构体 | |
| D. | 乙酸乙酯、油脂与NaOH溶液反应均有醇生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com