
| A. | 4甲基4,5二乙基己烷 | B. | 2,3-二甲基-2,4-戊二烯 | ||
| C. | CH3CH(OH)CH2CH3:丁醇 | D. | 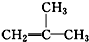 :2-甲基-1-丙烯 :2-甲基-1-丙烯 |
分析 A、有机物在命名时,在汉字和阿拉伯数字之间要用短线隔开;
B、烯烃命名时,要选含官能团的最长的碳链为主链,从离官能团最近的一端给主链上的碳原子编号,并表示出官能团的位置;
C、醇命名时,要选含官能团的最长的碳链为主链,从离官能团最近的一端给主链上的碳原子编号,并表示出官能团的位置;
D、烯烃命名时,要选含官能团的最长的碳链为主链,从离官能团最近的一端给主链上的碳原子编号,并表示出官能团的位置.
解答 解:A、有机物在命名时,在汉字和阿拉伯数字之间要用短线隔开,且碳链中的一个碳原子上不可能有3个取代基,故此有机物不存在,故A错误;
B、烯烃命名时,要选含官能团的最长的碳链为主链,故主链上有5个碳原子,从离官能团最近的一端给主链上的碳原子编号,故在1号和2号碳原子间、3号和4号碳原子间存在双键,在3号和4号碳原子上各有一个甲基,故名称为3,4-二甲基-1,3-戊二烯,故B错误;
C、醇命名时,要选含官能团的最长的碳链为主链,故主链上有4个碳原子,从离官能团最近的一端给主链上的碳原子编号,故在2号碳原子上有-OH,故名称为2-丁醇,故C错误;
D、烯烃命名时,要选含官能团的最长的碳链为主链,故主链上有3个碳原子,从离官能团最近的一端给主链上的碳原子编号,故碳碳双键在1号和2号碳原子间,在2号碳原子上有一个甲基,故名称为2-甲基-1-丙烯,故D正确.
故选D.
点评 本题考查了烷烃、烯烃和醇的命名,应注意的是含官能团的有机物在命名时,要以官能团为考虑对象来命名.


科目:高中化学 来源: 题型:解答题
| 离 子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 20℃ | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
| s(g/100g水) | 111 | 33.7 | 11.1 | 6.34 |
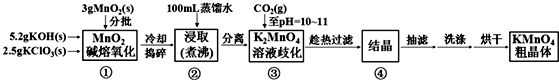
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,100mLPH=1的CH3COOH溶液中含有的H+总数大于0.01NA | |
| B. | 标准状况下,11g3H216O种含有的质子数为6NA | |
| C. | 1molLi2O和Na2O2的混合物中含有的离子总数为3NA | |
| D. | 1molN2与足量H2混合,充分反映后转移电子数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应除了生成新的物质外,还伴随着能量的变化 | |
| B. | 物质燃烧不一定是放热反应 | |
| C. | 放热的化学反应不需要加热就能发生 | |
| D. | 吸热反应不加热就不会发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. ;B与D形成的化合物BD2的结构式是O=C=O,BD2属于共价(填“离子”或“共价”)化合物.
;B与D形成的化合物BD2的结构式是O=C=O,BD2属于共价(填“离子”或“共价”)化合物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com