
 下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
| 编号 | 性质 | 化学方程式或文字说明 |
| 示例 | 漂白性 | 与某些有色物质形成不稳定的无色物质 |
| Ⅰ | 还原性 | 2H2O+2SO2+O2=2HSO4 |
| Ⅱ | ||
| Ⅲ |
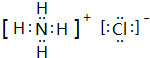 ,溶液中铵根离子水解:NH4++H2O?NH3?H2O+H+,破坏水的电离平衡,溶液呈酸性,
,溶液中铵根离子水解:NH4++H2O?NH3?H2O+H+,破坏水的电离平衡,溶液呈酸性,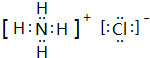 ;酸;
;酸;| Ⅱ | 酸性氧化物 | SO2+2NaOH═Na2SO3+H2O |
| Ⅲ | 氧化性 | 2H2S+SO2═3S↓+2H2O |
| ||
| ||


科目:高中化学 来源: 题型:
| 操 作 步 骤 | 实验现象 | 结 论 |
| 步骤Ⅰ:取少量待检液于试管中, |
溶液中含有Fe2+ | |
| 步骤Ⅱ:取少量待检液于试管中, |
溶液中含有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 现有25℃时0.1mol?L-1的氨水和0.1mol?L-1的NaOH溶液,若向各20mL的氨水和NaOH溶液中分别滴加0.1mol?L-1的稀盐酸,滴定曲线如图所示,请回答以下问题.
现有25℃时0.1mol?L-1的氨水和0.1mol?L-1的NaOH溶液,若向各20mL的氨水和NaOH溶液中分别滴加0.1mol?L-1的稀盐酸,滴定曲线如图所示,请回答以下问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| O2 |
| △ |
| 盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 近期曝出的“毒大米”事件,引起了国人的震惊和忧虑,又一次把环境问题摆在了我们面前.“毒大米”是由镉污染引起的,会对人体健康造成严重危害.镉元素在元素周期表中的图示如图所示.
近期曝出的“毒大米”事件,引起了国人的震惊和忧虑,又一次把环境问题摆在了我们面前.“毒大米”是由镉污染引起的,会对人体健康造成严重危害.镉元素在元素周期表中的图示如图所示.| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 甲 | 乙 | |
| A. | 过氧化钠和水 | 浓氨水和SO2 |
| B. | 浓盐酸和MnO2 | BaCl2溶液和SO2 |
| C. | 冷的浓硫酸和铝 | NaOH溶液和Cl2 |
| D. | 浓硫酸和蔗糖(滴有几滴水) | H2SO4溶液和氨气 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将pH=4的某酸稀释10倍,测得其pH<5,则该酸为弱酸 |
| B、0.1mol?L-1的NaHCO3溶液中c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-) |
| C、0.1mol?L-1的NaHA溶液pH=5,则溶液:c(HA-)>c(H+)>c(A2+)>c(H2A) |
| D、pH=4的醋酸与pH=10的氢氧化钠溶液等体积混合,所得溶液pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④ | B、③④⑤ |
| C、①④⑤ | D、②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com