1.5molH3PO4的质量是______,含有______个H3PO 4分子;同温、同压下等质量的SO2和SO3它们所占的体积比为______,所含氧元素的物质的量之比为______.
【答案】
分析:①根据物质的量、质量、摩尔质量之间的关系计算;
②根据物质的量、分子数、阿伏伽德罗常数之间的关系计算;
③根据质量、摩尔质量、气体摩尔体积之间的关系计算其体积比;
④先根据质量、摩尔质量、之间的关系计算物质的量,再根据分子中含有的氧原子个数计算氧元素的物质的量之比.
解答:解:①m=nM=1.5mol×98g/mol=147g,
②N=nN
A=1.5mol×N
A个/mol=1.5N
A,
③V(SO
2):V(SO
3)=
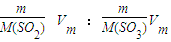
=
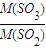
=
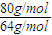
=5:4,
④每个二氧化硫分子中含2个氧原子,每个三氧化硫分子中含3个氧原子,所以氧元素的物质的量之比为:

=
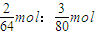
=5:6;
故答案为:147g;1.5N
A(9.03×10
23);5:4;5:6.
点评:本题考查了阿伏伽德罗常数的有关计算,求分子中原子的物质的量时,只有明确分子与原子之间的关系才能正确解答.

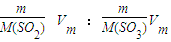 =
=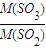 =
=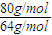 =5:4,
=5:4, =
=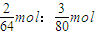 =5:6;
=5:6;
