
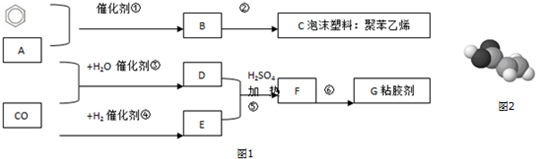

 .
. 分析 根据流程图可知,C为聚苯乙烯,则B为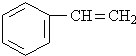 ,B发生加聚反应得C,A和苯反应生成B,则A为CH≡CH,A与苯发生加成反应得B,根据D的比例模型及乙炔与一氧化碳、水反应生成D可知,D为CH2=CHCOOH,E是乙醇的一种最简单的同系物,则E为HOCH3,D和E发生酯化反应生成的F为CH2=CHCOOCH3,F发生加聚反应得G为
,B发生加聚反应得C,A和苯反应生成B,则A为CH≡CH,A与苯发生加成反应得B,根据D的比例模型及乙炔与一氧化碳、水反应生成D可知,D为CH2=CHCOOH,E是乙醇的一种最简单的同系物,则E为HOCH3,D和E发生酯化反应生成的F为CH2=CHCOOCH3,F发生加聚反应得G为 ,CO与氢气发生加成反应得甲醇,据此答题.
,CO与氢气发生加成反应得甲醇,据此答题.
解答 解:根据流程图可知,C为聚苯乙烯,则B为 ,B发生加聚反应得C,A和苯反应生成B,则A为CH≡CH,A与苯发生加成反应得B,根据D的比例模型及乙炔与一氧化碳、水反应生成D可知,D为CH2=CHCOOH,E是乙醇的一种最简单的同系物,则E为HOCH3,D和E发生酯化反应生成的F为CH2=CHCOOCH3,F发生加聚反应得G为
,B发生加聚反应得C,A和苯反应生成B,则A为CH≡CH,A与苯发生加成反应得B,根据D的比例模型及乙炔与一氧化碳、水反应生成D可知,D为CH2=CHCOOH,E是乙醇的一种最简单的同系物,则E为HOCH3,D和E发生酯化反应生成的F为CH2=CHCOOCH3,F发生加聚反应得G为 ,CO与氢气发生加成反应得甲醇,
,CO与氢气发生加成反应得甲醇,
(1)D为CH2=CHCOOH,D中含氧官能团的名称为羧基,
故答案为:羧基;
(2)根据上面的分析可知,G的结构简式为  ,
,
故答案为: ;
;
(3)根据上面的分析可知,反应①-⑥中属于加成反应的是①,
故答案为:①;
(4)D与E的反应方程式为 CH2=CHCOOH+CH3OH$→_{△}^{浓硫酸}$CH2=CHCOOCH3+H2O,
故答案为:CH2=CHCOOH+CH3OH$→_{△}^{浓硫酸}$CH2=CHCOOCH3+H2O;
(5)D为CH2=CHCOOH,I是D的一种同系物,则I中含有碳碳双键和羧基,与F互为同分异构体,F为CH2=CHCOOCH3,则I的分子式为C4H6O2,且三种物质具有相同种数化学环境的氢,即都有三种环境的氢,则符合条件的I的结构简式为 ,
,
故答案为: .
.
点评 本题考查有机物的推断与合成,为高频考点,侧重于学生的分析能力的考查,注意根据有机物的结构进行分析判断,是对学生综合能力与逻辑推理能力的考查,答题时注意把握物质的性质.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:选择题
| A. | 大理石溶于醋酸的反应:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O | |
| B. | 实验室制取CO2:CO32-+2H+═CO2↑+H2O | |
| C. | 铁和硝酸银溶液反应:Fe+Ag+═Ag+Fe2+ | |
| D. | Ca(HCO3)2溶液中加入过量KOH溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Al3+>O2- | B. | 与水反应的激烈程度:Al>Mg | ||
| C. | 热稳定性:HF>NH3 | D. | 单质的氧化性:S>O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷和氯气按1:1混合,在光照下发生取代反应时,有机产物只有一种 | |
| B. | 在氧气中燃烧时只生成CO2和H2O的物质一定是烃 | |
| C. | 乙酸是有机弱酸,所以它的酸性比碳酸弱 | |
| D. | 在酯化反应中,羧酸脱去羧基中的羟基,醇脱去羟基中的氢而生成酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①②③④ | C. | ③④ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
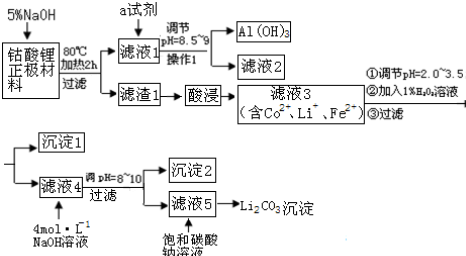
| 金属氢氧化物 | 金属离子浓度 1mol•L-1 | 金属离子浓度 0.1mol•L-1 | 沉淀完全时的pH值 | |
| 分子式 | Ksp | 开始沉淀时的pH | ||
| Fe(OH)2 | 4.87×10-17 | 5.8 | 6.3 | 8.3 |
| Fe(OH)3 | 2.79×10-39 | 1.2 | 1.5 | 2.8 |
| Co(OH)2 | 5.92×10-15 | 6.9 | 7.4 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、H+、Ba2+、CO32- | B. | K+、Na+、Ag+、Cl- | ||
| C. | H+、Mg2+、HCO3-、SO42- | D. | Ba2+、Cl-、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小于100mL | B. | 等于100mL | C. | 大于100mL | D. | 等于$\frac{100}{d}$mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com