
下列方法中,正确的是( )
|
| A. | 用湿润的红色石蕊试纸检验氨气 |
|
| B. | 在样品溶液中先加入硝酸银溶液,再加入稀硝酸,若白色沉淀存在,则样品中含有Cl﹣ |
|
| C. | 将熟石灰和氯化铵混合加热,可以制备氨气 |
|
| D. | 加热试管中的氯化铵固体 |
考点:
氨的实验室制法;常见气体的检验;常见阴离子的检验.
分析:
A.氨气与水反应生成一水合氨,一水合氨电离生成氢氧根离子,溶液显碱性;
B.氯离子检验时,先加硝酸排除其它离子的干扰;
C.氯化铵与氢氧化钙在加热条件下反应生成氯化钙、氨气和水;
D.加热氯化铵生成氨气和氯化氢,氨气和氯化氢遇冷又生成氯化铵,很难制取氨气.
解答:
解:A.氨气与水反应生成一水合氨,一水合氨电离生成氢氧根离子,溶液显碱性,能够使湿润的红色石蕊试纸变蓝,故A正确;
B.检验氯离子存在应排除杂质离子干扰,应先加入稀硝酸进行酸化,然后加入硝酸银溶液,若白色沉淀存在,则氯离子存在,故B错误;
C.氯化铵与氢氧化钙在加热条件下反应生成氯化钙、氨气和水,实验室用于制备氨气,故C正确;
D.氯化铵受热分解成氨气和氯化氢,但氨气和氯化氢在试管口又可以化合成氯化铵,不能用于制备氨气,故D错误;
故选:AC.
点评:
本题考查了氨气的制备及性质的检验,侧重考查学生对基础知识的掌握,题目难度不大.


科目:高中化学 来源: 题型:
如表为长式周期表的一部分,其中的序号代表对应的元素.
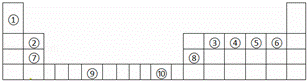
(1)写出上表中元素⑤的轨道表示式 ,元素⑨原子的核外电子排布式 .
(2)元素第一电离能的大小比较:④ ⑤(填写“>”“=”或“<”,下同);元素电负性的大小比较:④ ⑤(填写“>”“=”或“<”);请写出与元素④的单质互为等电子体的一种微粒的化学式 .
(3)在测定元素①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是 .
(4)上述③与④元素组成的(CN)2化合物中σ键与π键之比 .
(5)⑦的氧化物是优良的耐高温材料,它的熔点比CaO高,其原因是 .
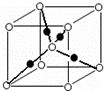
(6)元素⑩的某种氧化物的晶体结构如图所示,其中实心球表示元素⑩原子,则该氧化物的化学式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
以下做法达不到目的是( )
|
| A. | 蚊虫叮咬时,会释放一种酸性物质,在叮咬处抹些肥皂水(弱碱性),可减轻痛痒症状 |
|
| B. | 多吃海带,可预防因缺碘引起的甲状腺肿大 |
|
| C. | 对生活中的塑料垃圾进行填埋,可防止“白色污染” |
|
| D. | 将碗、筷高温蒸煮,可杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的分子中既有σ键,又有π键的是( )
①HCl ②H2O ③N2 ④H2O2 ⑤C2H4 ⑥C2H2.
|
| A. | ①②③ | B. | ③④⑤⑥ | C. | ①③⑥ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、D、E、F、G六种前四周期的元素,A是宇宙中最丰富的元素,B和D的原子都有1个未成对电子,B+比D少一个电子层,D原子得一个电子填入3p轨道后,3p轨道全充满;E原子的2p轨道中有3个未成对电子,F的最高化合价和最低化合价的代数和为4.R是由B、F两元素形成的离子化合物,其中B+与F2﹣离子数之比为2:1.G位于周期表第6纵行且是六种元素中原子序数最大的.
请回答下列问题:
(1)D元素的电负性 F元素的电负性(填“>”、“<”或“=”).
(2)G的价电子排布图 .
(3)B形成的晶体堆积方式为 ,空间利用率为 区分晶体和非晶体最可靠的科学方法是对固体进行 实验.
(4)D﹣的最外层共有 种不同运动状态的电子,有 种能量不同的电子.F2D2广泛用于橡胶工业,各原子均满足八电子稳定结构,F2D2中F原子的杂化类型是 ,F2D2是 分子(填“极性”或“非极性”).
(5)A与E形成的最简单化合物分子在水中溶解度很大的原因 .该分子是极性分子的原因 是 .
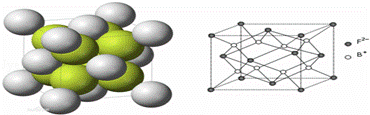
(6)如图所示是R形成的晶体的晶胞,设该晶体密度是ρ/g•cm﹣3.试计算R晶胞的体积是 (阿伏加德罗常数用NA表示,只写出计算式,不用计算)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com