
����Ŀ��25��ʱ����Ũ��Ϊ0.1000molL��1��NaOH��Һ�ֱ�ζ�20.00mLŨ�Ⱦ�Ϊ0.1000molL��1������ʹ�����Һ�ĵζ�������ͼ��ʾ�������Һ����仯���Բ��ƣ�������˵������ȷ���ǣ� �� 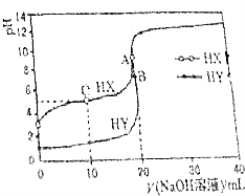
A.���ݵζ����ߣ��ɵ�Ka��CH3COOH����10��5
B.pH=7ʱ���ζ�������Һ���ĵ�V��NaOH��Һ����20mL
C.C����Һ��c��HX����c��X������c��Na+����c��H+����c��OH����
D.��V��NaOH��Һ��=20mLʱ��A��ˮ�����c��H+������B��ˮ�������c��H+��
���𰸡�C
���������⣺0.1000molL��1��������ҺPHֵ����1������HX�Ǵ��ᣬHY�����ᣬ A����NaOH��Һ�ε�10mLʱ����Һ��c��HX����c��X��������Ka��HX����c��H+��=10��pH �� ����pH��4����Ka��CH3COOH����10��5 �� ��A��ȷ��
B��HXΪ������ʣ�V��NaOH��=20mLʱ��HX����������ǡ����ȫ��Ӧ����NaX��X��ˮ����Һ��ʾ���ԣ����Եζ�������Һ���ĵ�V��NaOH��Һ����20mL����B��ȷ��
C��C����ҺΪ�����ʵ���Ũ�ȵĴ���ʹ����ƣ��Դ���ĵ���Ϊ������������Ũ�ȴ�СΪ��c��X������c��Na+����c��HX����c��H+����c��OH��������C����
D����V��NaOH��Һ��=20mLʱ��A���ˮ��ҺΪ�����ƣ���B���ˮ��ҺΪ�Ȼ��ƣ���������ǿ��������ˮ���ˮ�ĵ�����ٽ����ã�����Aˮ�����c��H+������B��ˮ�������c��H+������D��ȷ��
��ѡC��
0.1000molL��1��������ҺPHֵ����1������HX�Ǵ��ᣬHY�����ᣬ
A�������������Ƶε�10mLʱ��c��HX����c��X������Ka��HX����c��H+����
B��HXΪ������ʣ�V��NaOH��=20mLʱ��HX����������ǡ����ȫ��Ӧ����NaX��X��ˮ����Һ��ʾ���ԣ�
C��C����ҺΪ�����ʵ���Ũ�ȵĴ���ʹ����ƣ��Դ���ĵ���Ϊ����
D����V��NaOH��Һ��=20mLʱ��A���ˮ��ҺΪ�����ƣ���B���ˮ��ҺΪ�Ȼ��ƣ���������ǿ��������ˮ���ˮ�ĵ�����ٽ����ã�����Aˮ�����c��H+������B��ˮ�������c��H+����


 �ľ�ͼ���ʱ�ȷ�ϵ�д�
�ľ�ͼ���ʱ�ȷ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ŵ�����һ���������ʪ�Թؽ���ҩ���ͨ�����·����ϳɣ� 
��ش��������⣺
��1����ŵ����еĺ���������Ϊ���������ƣ���
��2����Ӧ���м�����Լ�X�ķ���ʽΪC8H8O2 �� X�Ľṹ��ʽΪ ��
��3���������岽��Ӧ�У�����ȡ����Ӧ����������ţ���
��4��B��һ��ͬ���칹����������������
���ܷ���������Ӧ����ˮ�����֮һ����FeCl3��Һ������ɫ��Ӧ��
��������6�ֲ�ͬ��ѧ�������⣬�ҷ����к�������������
д����ͬ���칹��Ľṹ��ʽ�� ��
��5����������֪ʶ����������Ϣ��д���� ![]() Ϊԭ���Ʊ�
Ϊԭ���Ʊ�  �ĺϳ�·������ͼ�����Լ����ã����ϳ�·��·��ͼʾ�����£�
�ĺϳ�·������ͼ�����Լ����ã����ϳ�·��·��ͼʾ�����£�
CH3CH2Br ![]() CH3CH2OH
CH3CH2OH ![]() CH3COOCH2CH3 ��
CH3COOCH2CH3 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20mL��ijϡH2S04��Һ�е���0.1mol/L��ˮ����Һ��ˮ�����������Ũ������˰�ˮ����仯��ͼ�����з�����ȷ���ǣ� �� 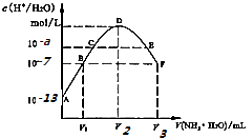
A.ϡ�����Ũ��Ϊ0.1mol/L
B.C����ҺpH=14��a
C.E��Һ�д��ڣ�c��NH4+����c��SO42������c��H+����c��OH����
D.B��D,D��F���Ӱ�ˮ���һ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ������ȷ���ǣ� ��
A.ȩ���Ľṹ��ʽ��COH
B.��ϩ���ӵĽṹ��ʽΪ��CH3CHCH2
C.���Ȼ�̼���ӵĵ���ʽΪ�� ![]()
D.2���һ���1��3������ϩ�ļ���ʽ�� ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���ijЩ�������˵����ȷ���ǣ� ��
A. NO2��Na2O2������ˮ����������ԭ��Ӧ
B. NO��CO2�����������ſ������ռ�
C. CO2��SO2���ó���ʯ��ˮ����
D. CO2��SO3��������Ӧ������O2��ȼ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£������ΪVL���ܱ������з�����Ӧ��mA+nBpC��t��ĩ��A������1mol��B������1.25mol��C������0.5mol����m��n��pӦΪ�� ��
A.4��5��2
B.2��5��4
C.1��3��2
D.3��2��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ͼ��ʾ��ʵ��װ����̽������ˮ��Ӧ������̨��������ȥ����ʵ��ǰ�������¶˴�һ��С��Ѩ����һ��С���е��ƿ�̶�����ͷ�¶ˣ����ϳ鶯��ͷʹ�ƿ���ڿ�Ѩ�ڣ��ڲ�����Ӧ����װ������ˮ��ʹ�ƿ鲻��ˮ�Ӵ�����ʵ��ʱ����ȥ����ͷ����ס����������ͷ�������ϰ���ʹ����ˮ�Ӵ�����Ӧ���ڵ�Һ�屻����������ѹ�������������·����ձ��У��������ռ��ڷ�Ӧ���ڣ�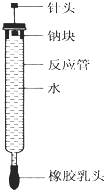
��1������ˮ��Ӧ�����ӷ���ʽΪ ��
��2��ʵ���С��ƿ��ۻ�Ϊ������С��˵�������ձ��е���Һ�еμ� �� ��Һ��죬˵������ˮ��Ӧ���ɼ������ʣ�
��3�����ʵ��ǰ���뷴Ӧ����ˮ�����Ϊa mL����ʹˮ����ȫ�����ų�������ȡ�����Ƶ���������Ϊg�����赱ʱʵ������������Ħ�����ΪV mL/mol��д����Ҫ���裩
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��0.5 mol Na2CO3��������Na+��ԼΪ��������
A.3.01��1023B.6.02��1023C.0.5D.1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�������������������������з�����ȡ�ģ�4HCl��Ũ��+MnO2 ![]() Cl2��+MnCl2+2H2O �Իش��������⣺
Cl2��+MnCl2+2H2O �Իش��������⣺
��1��ʵ�����пɲ�����Һ�������ж���������д���÷�Ӧ�����ӷ���ʽ ��
��2��ʵ��ȡ��������Ϊ36.5%���ܶ�Ϊ1.19gcm��3 �� Ũ����100mL����Ӧ�������������Ũ�ȱ�Ϊ1.9mol/L������������ı仯����������ʵ��������ɱ���µ�Cl2����L��д��������̣�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com