
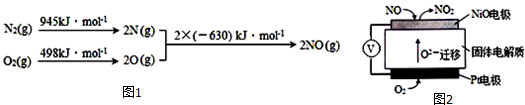
分析 (1)二氧化氮和水反应生成硝酸和一氧化氮;
(2)根据能量变化图计算反应热,反应热=吸收的能量-放出的能量,再根据热化学反应方程式的书写规则书写,从而求N2和O2生成1molNO所吸收的热量;
(3)①NO被CO还原,则CO被NO氧化生成二氧化碳,据此写出反应方程式;
②原子半径越大,其吸收范围越大,则吸收能力越强;
(4)①得电子的物质发生还原反应;
②NiO电极上NO失电子和氧离子反应生成二氧化氮.
解答 解:(1)二氧化氮和水反应生成硝酸和一氧化氮,反应方程式为:3NO2+H2O=2HNO3+NO,
故答案为:3NO2+H2O=2HNO3+NO;
(2)①该反应中的反应热=(945+498)kJ/mol-2×630kJ/mol=+183kJ/mol,所以其热化学反应方程式为:N2(g)+O2(g)=2NO(g)△H=+183 kJ•moL-1,所以1molNO所吸收的热量为183 kJ,
故答案为:183;
②该反应的正反应是吸热反应,升高温度,平衡向正反应方向移动,生成物浓度增大,反应物浓度减小,所以平衡常数增大,
故答案为:增大;
(3)①在催化剂条件下,一氧化碳被氧化生成二氧化碳,一氧化氮被还原生成氮气,所以其反应方程式为:2CO+2NO $\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2,
故答案为:2CO+2NO $\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2;
②根据Mg、Ca、Sr和Ba的质子数,得知它们均为ⅡA族元素.同一主族的元素,从上到下,原子半径逐渐增大,原子半径越大,反应接触面积越大,则吸收能力越大,
故答案为:根据Mg、Ca、Sr和Ba的质子数,得知它们均为ⅡA族元素,同一主族的元素,从上到下,原子半径逐渐增大.
(4)①铂电极上氧气得电子生成氧离子而被还原,
故答案为:还原;
②NiO电极上NO失电子和氧离子反应生成二氧化氮,所以电极反应式为:NO+O2--2e-=NO2,
故答案为:NO+O2--2e-=NO2.
点评 本题涉及化学反应方程式、热化学反应方程式、电极反应式的书写等知识点,注意反应热的计算方法,为易错点.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液 | |
| B. | 用托盘天平称量氢氧化钠时,直接放在托盘上称量 | |
| C. | 用稀硫酸洗涤并灼烧铂丝后,再进行焰色反应 | |
| D. | 取用化学药品时,应特别注意观察药品包装上的安全警示标志 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用渗析的方法制制氢氧化铁胶体 | |
| B. | SiO2、NaCl、I2、C2H6O均能真实表示物质分子组成 | |
| C. | ${\;}_{8}^{18}$O2-离子结构示意图 | |
| D. | 冰酸酸、铝热剂、硫酸钡、SO2分别屈于酸、混合物、强电解质、非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用过量氨水吸收工业尾气中的SO2:2NH3•H20+SO2═2NH4++SO32-+H2O | |
| B. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O | |
| C. | 用铜做电极电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ | |
| D. | 向含有Fe2O3悬浊液中通入HI:Fe2O3+6H+═2Fe3++3H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com