
共聚法可改进有机高分子化合物的性质,高分子聚合物P的合成路线如下:
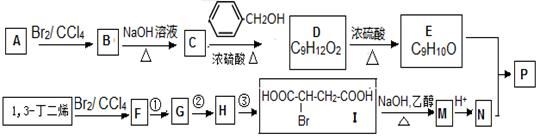
(1)B的名称为_____________,E中所含官能团的名称为 ;
(2)I由F经①~③合成,F可以使溴水褪色。
a.①的化学方程式是
b.②的反应试剂是
c.③的反应类型是
(3)下列说法正确的是
a.C可与水任意比例混合
b.A与1,3-丁二烯互为同系物
c.由I生成M时,1mol最多消耗3molNaOH
d.N不存在顺反异构体
(4)写出E与N按照物质的量之比为1:1发生共聚生成P的化学反应方程式 高聚物P的亲水性比由E形成的聚合物_____(填“强、弱”)。
(5)D的同系物K比D分子少一个碳原子,K 有多种同分异构体,符合下列条件的K的同分异构体有 种。写出其中核磁共振氢谱为1:2:2:2:3的一种同分异构体的结构简式 。
a.苯环上有两种等效氢
b.能与氢氧化钠溶液反应
c.一定条件下1mol该有机物与足量金属钠充分反应,生成1molH2
(1)1,2-二溴乙烷;醚键、碳碳双键
(2)a、
b、HBr c氧化反应
(3)a、c
(4)

强
(4)9 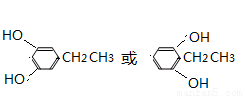
【解析】D分子中含有9个原子,它是C与苯甲醇在浓硫酸加热条件生成的,所以C含有2个原子,根据由A转化为C的关系知,A是CH2=CH2,B是CH2Br-CH2Br,名称是1,2-二溴乙烷,C是CH2OH-CH2OH,D是C6H5-CH2-O-CH2OH。D在浓作用下,发生消去反应,生成E,其结构为C6H5-OCH=CH2,它含有的官能团是醚基和碳碳双键。根据I的结构简式知,1,3丁二烯与Br2发生1,4加成,且F能使溴水褪色,则F是BrCH2-CH=CH-CH2Br,结合I可以推出,G是HOCH2-CH=CH-CH2OH,H是HOCH2-CH(Br)CH-CH2OH,M为NaOOC-CH=CH-COONa,N是HOOC-CH=CH-COOH。
(4)P中含有亲水官能团羧基,所以它亲水性比E要强;
(5)K比中少一碳原子,分子式为C8H10O2,它的同分异构体能与氢氧化钠溶液反应,且1mol能与足量钠反应产物1molH2,说明共结构中含有2个酚羟基,由于苯环上有2种等效氢。一方面是,两个羟基,一个是乙基,苯环上有三个取代基,羟基在对称位置上;另一方面是,两个羟基,两个甲基,这样共9种。符合核磁共振氢谱图,面积比为1:2:2:2:3是, 。
。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源:2014高考名师推荐化学镁、铝及其化合物主要性质(解析版) 题型:选择题
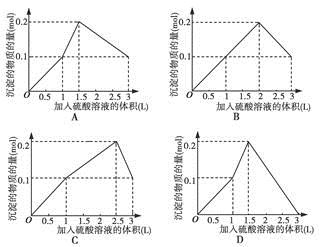
在1 L含0.1 mol NaAlO2和0.1 mol Ba(OH)2的混合溶液中,逐滴加入浓度为0.1 mol·L-1H2SO4溶液,下列图像中能表示反应产生沉淀的物质的量与加入硫酸溶液体积之间关系的是
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学速率表示与平衡移动(解析版) 题型:选择题
已知反应4NH3+5O2 4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列正确的关系是
4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列正确的关系是
A.v(NH3)=v(O2) B.v(O2)=v(H2O)
C.v(NH3)=v(H2O) D.v(O2)=v(NO)
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习5(解析版) 题型:填空题
有机物A、B的分子式均为C10H10O5,均能发生如下变化。
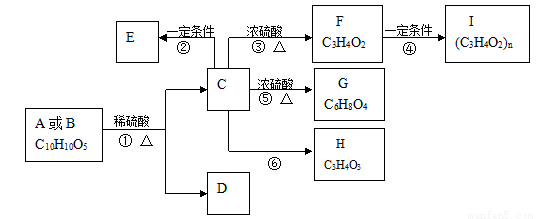
已知:
①A、B、C、D等均能与NaHCO3反应
②只有A、D能与FeCl3溶液发生显色反应,A苯环上的一溴代物只有两种
③F能使溴水褪色,
④H不能发生银镜反应
根据题意回答下列问题:
(1)反应③的反应类型是 ;有机物F含氧官能团的名称是 ;
(2)写出有机物的结构简式D 、H ;
(3)写出反应⑤的化学方程式 ;
(4)D的同分异构体有很多种,写出同时满足下列要求的所有同分异构体的结构简式 ;
①能与FeCl3溶液发生显色反应
②能发生银镜反应但不能水解
③苯环上的一卤代物只有2种
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习4(解析版) 题型:填空题
水处理主要包括水的净化、污水处理、硬水软化和海水淡化等。
(1)水处理技术的核心是减少或除去水中的各种杂质离子。目前________和________是主要的去离子方法。
(2)ClO2是一种性能优良的消毒剂,可将废水中少量的S2-、NO2-和CN-等有毒有害的还原性离子氧化除去。请写出ClO2将废水中剧毒的CN-氧化成无毒气体的离子方程式________。
(3)地下水往往含有钙、镁的碳酸盐,自来水厂需要对地下水进行________处理。把进行过离子交換的CaR2(或MgR2)型树脂置于______中浸泡一段时间后便可再生。
(4)海水的淡化是除去海水中所含的盐分,右面是海水利用电渗析法获得淡水的原理图,已知海水中含有Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请回答:
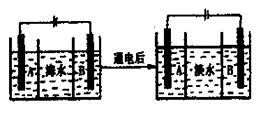
①阳离子交换膜是指________(填“A”或“B”)。
②写出通电后阳极区的电极反应式________________。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习3(解析版) 题型:填空题
Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用。
(1)与N3-含有相同电子数的三原子分子的空间构型是 。
(2)Cu具有良好的导电、导热和延展性,请解释Cu具有导电性的原因 。
(3)在Cu的催化作用下,乙醇可被空气氧化为乙醛,乙醛分子中碳原子的杂化方式是__________,乙醛分子中H—C—O的键角__________乙醇分子中的H—C—O的键角(填“大于”、“等于”或“小于”)。
(4)Cu+的核外电子排布式为 ,其在酸性溶液中不稳定,可发生歧化反应生成Cu2+和Cu,但CuO在高温下会分解成Cu2O,试从结构角度解释高温下CuO为何会生成Cu2O 。
(5)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代有两种不同的结构,试画出[Cu(H2O)2(Cl)2]具有极性的分子的结构式 。
(6)Cu3N的晶胞结构下图所示:
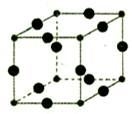
N3-的配位数为__________,Cu+半径为apm,N3-半径为b pm,Cu3N的密度__________g/cm3。(阿伏加德罗为常数用NA表示)
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习2(解析版) 题型:填空题
已知: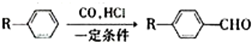
为合成某种液晶材料中间体M,有人提出如下不同的合成途径: 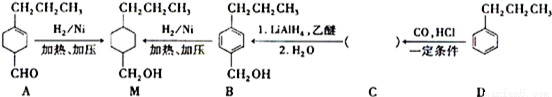
(1)常温下,下列物质能与A发生反应的有 (填序号)
a.苯 b.Br2/CCl4 c.乙酸乙酯 d.KMnO4/H+溶液
(2)M中官能团的名称是 ,由C→B反应类型 。
(3)由A催化加氢生成M的过程中,可能有中间生成物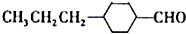 和 (写结构简式)生成。
和 (写结构简式)生成。
(4)检验B中是否含有C可选用试剂是 (任写一种名称)。
(5)物质B也可由C10H13Cl与NaOH水溶液共热生成,C10H13Cl的结构简式
(6)C的一种同分异构体E具有如下特点:
a.分子中含-OCH2CH3 b.苯环上只有两种化学环境不同的氢原子
写出E在一定条件下发生加聚反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学资源的综合应用(解析版) 题型:选择题
用铝热法还原下列氧化物制得金属各1 mol,消耗铝最少的是
A.MnO2B.WO3C.Cr2O3D.Co3O4
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学离子大量共存与推断(解析版) 题型:选择题
将足量的SO2通入下列各溶液中,所含离子还能大量共存的是
A.K+、SiO32-、Cl-、NO3-
B.H+、NH4+、Al3+、SO42-
C.Na+、Cl-、MnO4-、SO42-
D.Na+、CO32-、CH3COO-、HCO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com