
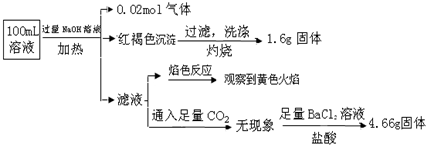
分析 CO32-与Fe3+、Cu2+、Ba2+、Al3+不能大量共存,OH-与Fe3+、Cu2+、Al3+不能大量共存;则必有的两种物质记为A、B,A、B分别为K2CO3、Ba(OH)2,C与A的溶液混合时产生蓝色沉淀,向该沉淀中滴入足量稀HNO3,沉淀部分溶解,剩余白色固体,蓝色沉淀为氢氧化铜,白色沉淀为硫酸钡,则A应为Ba(OH)2,C中含SO42-,则C为CuSO4,D为Al(NO3)3,E为FeCl3,据此分析解答即可.
解答 解:CO32-与Cu2+、Ba2+、Fe3+、Al3+不能大量共存,OH-与Fe3+、Al3+、Cu2+不能大量共存,则必有的两种物质记为A、B,A、B分别为K2CO3、Ba(OH)2,C与A的溶液混合时产生蓝色沉淀,向该沉淀中滴入足量稀HNO3,沉淀部分溶解,剩余白色固体,蓝色沉淀为氢氧化铜,白色沉淀为硫酸钡,则A应为Ba(OH)2,C中含SO42-,则C为CuSO4,D为Al(NO3)3,E为FeCl3.
(1)由上述分析可知,必有的两种物质为K2CO3、Ba(OH)2,
故答案为:K2CO3;Ba(OH)2;
(2)由上述分析可知,C为CuSO4,C中X为SO42-,
故答案为:②;
(3)根据以上推断可知D中含有NO3-,已知将19.2gCu投入装有足量D溶液的试管中,Cu不溶解;再滴加稀H2SO4,Cu逐渐溶解,
发生的反应为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O
则n(Cu)=mM=$\frac{19.2g}{64g/mol}$=0.3mol,
有方程可知$\frac{3}{8}$=$\frac{0.3mol}{n({H}^{+})}$,
所以n(H+)=0.8mol,
所以n(H2SO4)=12n(H+)=0.4mol,
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;0.4mol.
点评 本题综合性较强,涉及无机物推断、离子检验、离子方程式的书写等,需要学生熟练掌握基础知识,有利于考查学生的推理能力,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
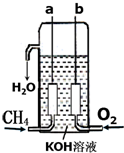 氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制.常用的燃料往往是某些碳氢化合物,如:甲烷、汽油等.已知甲烷燃料电池的负极有碳酸根离子生成,请写出如图所构成的甲烷燃料电池中:a极的电极反应式:CH4+10OH--8e-=CO32-+7H2O,b极的电极反应式:O2+2H2O+4e-=4OH-,若将KOH溶液换为稀H2SO4,则a极的电极反应式:CH4+2H2O-8e-=CO2+8H+.
氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制.常用的燃料往往是某些碳氢化合物,如:甲烷、汽油等.已知甲烷燃料电池的负极有碳酸根离子生成,请写出如图所构成的甲烷燃料电池中:a极的电极反应式:CH4+10OH--8e-=CO32-+7H2O,b极的电极反应式:O2+2H2O+4e-=4OH-,若将KOH溶液换为稀H2SO4,则a极的电极反应式:CH4+2H2O-8e-=CO2+8H+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①液体分层,下层呈无色 | |
| B. | ②洗涤沉淀时,向漏斗中加适量水,搅拌并滤干 | |
| C. | ③分离CCl4和水 | |
| D. | ④除去氯气中的氯化氢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | KHC2O4溶液呈弱碱性 | |
| B. | B点时:c(K+)>c(HC2O4-)>c(C2O42-)>c(H+)>c(OH-) | |
| C. | C点时:c(K+)<c(HC2O4- )+2c(C2O42-)+c(H2C2O4) | |
| D. | D点时:c(H+)+c(HC2O4-)+c(H2C2O4)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原溶液中c(Fe3+)=0.2 mol•L-1 | |
| B. | 溶液中至少有4种离子存在,其中Clˉ一定存在,且c(Clˉ)≥0.2 mol•L-1 | |
| C. | SO42ˉ、NH4+、Na+一定存在,CO32ˉ、Al3+一定不存在 | |
| D. | 取少量原溶液于试管中,加入KSCN溶液,溶液成血红色,说明该溶液一定没有Fe2+,只有Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| 0min | 5min | 10min | |
| CO | 0.1 | 0.05 | |
| H2 | 0.2 | 0.2 | |
| CH3OH | 0 | 0.04 | 0.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⅠA族元素的金属性一定比ⅡA族元素的金属性强 | |
| B. | ⅥA族元素中氢化物最稳定的其沸点一定最高 | |
| C. | 非金属元素形成的化合物中也可能是离子化合物 | |
| D. | 离子化合物中可能含有共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com