
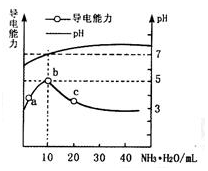
 常温下,向10mL 0.1mol•L-1的HR溶液中逐滴滴入0.1mol•L-1的NH3•H2O溶液,所得溶液pH及导电能力变化如图.下列分析不正确的是( )
常温下,向10mL 0.1mol•L-1的HR溶液中逐滴滴入0.1mol•L-1的NH3•H2O溶液,所得溶液pH及导电能力变化如图.下列分析不正确的是( )| A. | a~b点导电能力增强,说明HR为弱酸 | B. | b点溶液pH=7,此时酸碱恰好中和 | ||
| C. | c点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+) | D. | b、c两点水的电离程度:b<c |
分析 A.根据图象可知,a~b点导电能力增强,说明HR为弱电解质,在溶液中部分电离,加入氨水后生成强电解质,离子浓度增大;
B.b点溶液pH=7,此时加入10mLHR,HR与一水合氨的浓度、体积相等,则二者恰好反应;
C.c点时溶液的pH>7,混合液显示碱性,则c(OH-)>c(H+),结合电荷守恒可知:c(NH4+)>c(R-);
D.酸或碱抑制水电离,且酸中c(H+)越大、碱中c(OH-)越大,其抑制水电离程度越大,含有弱离子的盐促进水电离.
解答 解:A.a~b点导电能力增强,说明反应后溶液中离子浓度增大,也证明HR在溶液中部分电离,为弱酸,故A正确;
B.体积图象可知b点溶液pH=7,此时HR与一水合氨的物质的量相等,二者恰好反应生成NH4R,故B正确;
C.根据图象可知,c点时溶液的pH>7,混合液呈碱性,则c(OH-)>c(H+),结合电荷守恒可知:c(NH4+)>c(R-),故C正确;
D.a点酸碱恰好中和,为弱酸弱碱盐,c点氨水过量,一水合氨抑制水的电离,则b、c两点水的电离程度:b>c,故D错误.
故选D.
点评 本题考查了酸碱混合的定性判断、离子浓度定性比较、溶液导电性及其影响等知识,题目难度中等,明确酸碱混合的定性判断及溶液酸碱性与溶液pH的计算方法为解答关键,试题侧重考查学生的分析、理解能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 具有相同的质子数 | B. | 具有相同的中子数 | ||
| C. | 具有相同的质量数 | D. | 它们不互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用pH试纸测双氧水的pH | |
| B. | 用酸式滴定管量取20.00 mL酸性KMnO4溶液 | |
| C. | 用托盘天平称取 5.85 g NaCl晶体 | |
| D. | 用带磨口玻璃塞的试剂瓶保存Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述燃料电池的负极反应材料是氢气、甲烷、乙醇等物质 | |
| B. | 氮氧燃料电池常用于肮天飞行器,原因之一是该电池的产物为水,经过处理之后可供宇肮员使用 | |
| C. | 乙醇燃料电池的常用KOH溶液,该电池的负极反应为C2H5OH-12e-+3H2O═CO2↑+12H+ | |
| D. | 甲烷碱性燃料电池工作时OH-定向移动到负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  实验室制取氨气 | B. |  用CCl4萃取碘水中的碘 | ||
| C. |  比较Na2CO3与NaHCO3的稳定性 | D. | 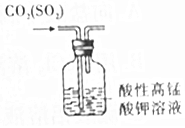 除去CO2中混有的少量SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干冰只能用于人工降雨 | |
| B. | Al(OH)3可以治疗胃酸过多,因此可大量使用 | |
| C. | 为了增强去污效果,在洗衣粉中添加三聚磷酸钠(Na5P3O10) | |
| D. | 侯氏制碱法不涉及基本反应类型中的置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | ||
| M | Y | Z |
| A. | 氢化物沸点最高的是H2X | B. | M4的摩尔质量为124 | ||
| C. | X、Y、Z的简单离子半径最大的是Z | D. | X、Y两种元素,化合价都可以显-1价 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com