
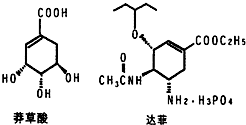
 目前世界上已证明“达菲”是治疗禽流感和甲型H1N1流感的良方.“达菲”的主要合成原料是我国盛产的莽草酸.从八角茴香中提取的莽草酸经过多次反应和其他工艺制成“达菲”颗粒.下图是莽草酸和“达菲”有效成分的键线式结构(楔形实线、虚线表示基团的立体结构).
目前世界上已证明“达菲”是治疗禽流感和甲型H1N1流感的良方.“达菲”的主要合成原料是我国盛产的莽草酸.从八角茴香中提取的莽草酸经过多次反应和其他工艺制成“达菲”颗粒.下图是莽草酸和“达菲”有效成分的键线式结构(楔形实线、虚线表示基团的立体结构).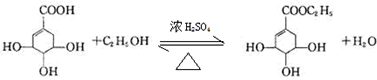 .
. .
. 分析 (1)“达菲”的相对分子质量为410.4,扣除H3PO4后的部分称为“自由基奥司他韦”,磷酸的相对分子质量为98;能与磷酸结合,说明氨基具有碱性;
(2)莽草酸中含-OH、-COOH、-C=C-;
(3)结合醇、烯烃、羧酸的性质分析;
(4)莽草酸中含-COOH与C2H5OH发生酯化反应;
(5)B的同分异构体中既含有酚羟基又含有酯基,存在邻、间、对三种位置.
解答 解:(1)“达菲”的相对分子质量为410.4,扣除H3PO4后的部分称为“自由基奥司他韦”,磷酸的相对分子质量为98,则“自由基奥司他韦”的相对分子质量为410.4-98=312.4;能与磷酸结合,说明氨基具有碱性,故答案为:312.4;碱;
(2)莽草酸中含-OH、-COOH、-C=C-,名称分别为羟基、羧基、碳碳双键,故答案为:羟基、羧基、碳碳双键;
(3)①由结构可知分子式为C7H10O5,故正确;
②不含酚-OH,额不能使FeCl3溶液显紫色,故错误;
③含双键,能使溴的四氯化碳溶液褪色,故正确;
④-OH、-COOH均与Na反应,只有-COOH与NaOH反应,则l mol莽草酸与分别足量的Na和NaOH反应,消耗的Na和NaOH的物质的量之比为4:l,故正确;
故答案为:①③④;
(4)莽草酸与乙醇发生酯化反应生成酯和水,反应方程式为 ,
,
故答案为: ;
;
(5)B的分子式为C7H6O3,其中只能含有1个-COO-(酯基)和1个-OH(酚羟基),两者的相对位置有邻、间、对三种情况,对应物质的分别为 ,
,
故答案为:3; .
.
点评 本题考查较为综合,侧重于有机物的结构和性质的考查,为高考常见题型,难度不大,注意把握有机物的官能团的性质,结合题给信息判断有机物的结构简式.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子晶体都是单质 | |
| B. | 分子晶体在常温下不可能为固态 | |
| C. | 非金属元素的气态氢化物越稳定,其氧化物对应的水化物酸性越强 | |
| D. | 非金属元素的气态氢化物相对分子质量越大,熔沸点不一定越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:3 | C. | 1:4 | D. | 1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,16g O2和O3混合物中所含原子数为NA | |
| B. | 标准状况下,等体积 Cl2和CCl4中所含氯原子数为1﹕2 | |
| C. | 常温常压下,14g N2含有电子数为7NA | |
| D. | 28g CO与22.4L CO2所含的碳原子数均为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
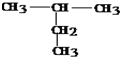 :2-甲基丁烷
:2-甲基丁烷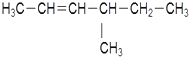 :4-甲基-2-己烯
:4-甲基-2-己烯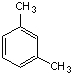 1,3-二甲苯.
1,3-二甲苯.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
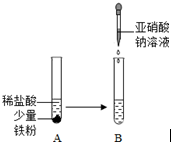 亚硝酸钠(NaNO2)俗称工业盐,外观和食盐相似,有咸味,易溶于水,水溶液显碱性,加强热时能分解产生有刺激性气味的气体,人若误食会引起中毒,致死量为0.3g~0.5g,它使人中毒是因为它能将人体血红蛋白中的Fe2+转化为Fe3+,从而使血红蛋白丧失携氧能力.
亚硝酸钠(NaNO2)俗称工业盐,外观和食盐相似,有咸味,易溶于水,水溶液显碱性,加强热时能分解产生有刺激性气味的气体,人若误食会引起中毒,致死量为0.3g~0.5g,它使人中毒是因为它能将人体血红蛋白中的Fe2+转化为Fe3+,从而使血红蛋白丧失携氧能力.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com