
 为测定含有Na2O杂质的Na2O2样品的纯度,甲同学设计以下的方案.用如图所示装置,通过测定Na2O2与C02反应生成02的体积来测定样品的纯度.
为测定含有Na2O杂质的Na2O2样品的纯度,甲同学设计以下的方案.用如图所示装置,通过测定Na2O2与C02反应生成02的体积来测定样品的纯度.分析 通过测定Na2O2与C02反应生成02的体积来测定样品的纯度,装置图中稀盐酸滴入石灰石生成二氧化碳,进入装置B硬质玻璃管中反应,生成的氧气通过装置C中的氢氧化钠溶液除去剩余的二氧化碳气体,利用装置D量气管测定生成氧气体积,计算物质的量计算的过氧化钠的质量分数;
(1)氢氧化钠能和二氧化碳反应,不和氧气反应;
(2)橡皮管可以沟通锥形瓶和分液漏斗中的大气压强,还可以避免盐酸排空气;
(3)若果测的氧气的量比实际值高,则过氧化钠的纯度装置就会偏高,反之则偏低;
(4)称取一定质量样品,测定与水反应生成氧气的体积(标准状况),计算得到过氧化钠质量,得到样品的纯度;
解答 解:(1)C的作用是吸收二氧化碳,保证排水量气法获得的是氧气的体积,
故答案为:NaOH溶液;
(2)A中橡皮管可以沟通锥形瓶和分液漏斗,起恒压作用,使盐酸容易滴下,并且可以避免盐酸排空气使氧气体积偏大,
故答案为:起恒压作用,使盐酸容易滴下;避免盐酸排空气使氧气体积偏大;
(3)a、装置A、B中的空气会导致测得的氧气体积偏高,对测定结果产生影响,故a正确;
b、在调节U形量气管中的液面相平的过程中,排除了装置C中的空气对测定结果产生的影响,故b错误;
c、读数时U形量气管中的液面左低右高时,所测Na2O2的纯度会偏小,故c错误.
d、读数时U形量气管中的液面要保持向平,左高右低,所测Na2O2的纯度会偏大,故d正确;
故选ad.
(4)称取一定质量样品,测定与水反应,用量气管测定生成氧气的体积(标准状况),计算得到过氧化钠质量,得到样品的纯度,可以利用装置图测定;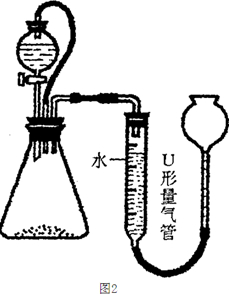 ;
;
故答案为: ;
;
点评 本题考查了物质纯度的实验设计和过程分析判断,主要是误差判断方法和装置设计应用,掌握基础是解题关键,题目难度中等.


 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:填空题

 .
.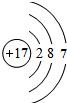 ,其最高价氧化物对应的水化物的化学式为HClO4.
,其最高价氧化物对应的水化物的化学式为HClO4.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 微粒代码 | a | b | c | d | e | f | g |
| 原子核数目 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 带电荷数(单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
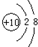
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol | B. | 0.02mol | C. | 0.03mol | D. | 0.04mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32 | B. | 67 | C. | 99 | D. | 166 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯既可使溴的四氯化碳溶液褪色,也可使酸性高锰酸钾溶液褪色 | |
| B. | 有机物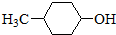 的消去产物有两种 的消去产物有两种 | |
| C. | 有机物C4H6O2能发生加聚反应,可推知其结构一定是CH2=CH-COOCH3 | |
| D. | 可用溴水鉴别苯酚、四氯化碳和乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,含1 mol Fe的铁片与过量浓HNO3反应,转移电子的数目为3 NA个 | |
| B. | 19.2 g铜与足量的稀硝酸反应产生NO的体积为4.48 L | |
| C. | 标准状况下,33.6 L SO3含有9.03×1023个SO3分子 | |
| D. | 在46 gNO2和N2O4的混合物气体中所含原子总数为3NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com