
【题目】硝酸在化学工业中有着极其广泛的应用.
(1)将1.25mol的NO、NO2、N2O4混合物(其中NO的体积分数为0.60)通入水中,在空气充足的条件下完全反应后可获得硝酸的物质的量范围是 .
(2)向稀硝酸中加入18.4mol/L的浓硫酸(98%)作吸水剂并蒸馏得浓硝酸,当其浓度下降到87%(密度1.8g/cm3)以下时,则失去吸水能力.50mL 18.4mol/L的浓硫酸作为吸水剂时,最多可吸水g.
(3)在65%的HNO3(质量m1)中加入72%的Mg(NO3)2(质量m2)后蒸馏,分别得到97.5%的HNO3和60%的Mg(NO3)2溶液(其中不含硝酸).若蒸馏过程中,硝酸、硝酸镁均无损耗,H2O的损耗占总质量的5%,则蒸馏前投料比 ![]() = .
= .
(4)硝酸工业中的尾气用烧碱进行吸收产物为NaNO2、NaNO3和H2O.现有含0.50mol氮氧化物的尾气,恰好被一定量的NaOH溶液完全吸收.已知反应后溶液含有0.35molNaNO2 . 若将尾气NO和NO2的平均组成用NOx表示,则x= .
【答案】
(1)1.25mol<n(HNO3)<1.75mol
(2)11.63
(3)0.88
(4)1.8
【解析】解:(1)NO的物质的量为1.25mol×0.6=0.75mol,则NO2、N2O4总物质的量为1.25mol﹣0.75mol=0.5mol,气体全部为NO、NO2时,得到硝酸最少,根据N原子守恒,得到硝酸极小值为1.25mol,气体为NO、N2O4时得到硝酸最多,根据N原子守恒,得到硝酸极大值为0.75mol+0.5mol×2=1.75mol,则:1.25mol<n(HNO3)<1.75mol,所以答案是:1.25mol<n(HNO3)<1.75mol;(2)98%浓硫酸密度为:ρ= ![]() =
= ![]() g/mL=1.84g/mL,87%(密度1.8g/cm3)的硫酸物质的量浓度为:
g/mL=1.84g/mL,87%(密度1.8g/cm3)的硫酸物质的量浓度为: ![]() mol/L,根据稀释定律,50mL浓硫酸吸水失去吸水能力后溶液体积为:
mol/L,根据稀释定律,50mL浓硫酸吸水失去吸水能力后溶液体积为: ![]() =57.57mL,则吸收水的质量为:57.57mL×1.8g/mL﹣50mL×1.84g/mL=11.63g,所以答案是:11.63;(3)蒸馏后得到97.5%的HNO3的质量为:
=57.57mL,则吸收水的质量为:57.57mL×1.8g/mL﹣50mL×1.84g/mL=11.63g,所以答案是:11.63;(3)蒸馏后得到97.5%的HNO3的质量为: ![]() ,得到60%的Mg(NO3)2溶液质量为:
,得到60%的Mg(NO3)2溶液质量为: ![]() ,损耗水的总质量为(m1+m2)×5%,则:
,损耗水的总质量为(m1+m2)×5%,则: ![]() +
+ ![]() =(m1+m2)﹣(m1+m2)×5%,整理可得:
=(m1+m2)﹣(m1+m2)×5%,整理可得: ![]() =0.88所以答案是:0.88;(4)根据N原子守恒得n(NaNO3)=n(NOx)﹣n(NaNO2)=0.5mol﹣0.35mol=0.15mol, 由 2NO2+2NaOH=NaNO2+NaNO3+H2O,可知生成0.15mol硝酸钠需要0.3molNO2 , 同时生成0.15mol亚硝酸钠,则反应NO+NO2+2NaOH=2NaNO2+H2O生成的亚硝酸钠为0.35mol﹣0.15mol=0.2mol,则该反应中消耗0.1molNO2、0.1molNO,所以原混合气体中NO、NO2的物质的量分别是0.1mol、0.4mol,尾气中NO与NO2的平均组成记为NOx , 则:x=
=0.88所以答案是:0.88;(4)根据N原子守恒得n(NaNO3)=n(NOx)﹣n(NaNO2)=0.5mol﹣0.35mol=0.15mol, 由 2NO2+2NaOH=NaNO2+NaNO3+H2O,可知生成0.15mol硝酸钠需要0.3molNO2 , 同时生成0.15mol亚硝酸钠,则反应NO+NO2+2NaOH=2NaNO2+H2O生成的亚硝酸钠为0.35mol﹣0.15mol=0.2mol,则该反应中消耗0.1molNO2、0.1molNO,所以原混合气体中NO、NO2的物质的量分别是0.1mol、0.4mol,尾气中NO与NO2的平均组成记为NOx , 则:x= ![]() =1.8,
=1.8,
所以答案是:1.8.


科目:高中化学 来源: 题型:
【题目】如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比最接近于( ) 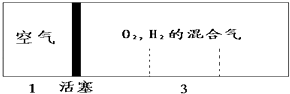
A.2:7
B.4:5
C.5:4
D.7:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应 X+2Y = R+2M 中,已知R和M的摩尔质量之比为22:9,当1.6g X与Y完全反应后,生成4.4 g R, 则此反应中Y和M的质量之比为( )
A. 16:9 B. 23:9 C. 32:9 D. 46:9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)CH3OH(g)
(1)如表所列数据是该反应在不同温度下的化学平衡常数(K)
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①该反应的熵变△S0 ( 填:“<,>,=”).该反应在(填:高温或低温)条件下能自发进行.
②要提高CO的转化率,可以采取的措施是(填序号).
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压
e.加入惰性气体加压 f.分离出甲醇
(2)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率AC(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数AC,由状态B到状态A,可采用的方法(填“升温”或“降温”). 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,两个体积相同的容器,一个盛有CO,另一个盛有O2、H2的混合气体,两瓶中气体一定具有相同的( )
A.质量 B.电子总数C.原子总数 D.密度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于硝酸的认识,正确的是( )
A.浓硝酸和稀硝酸都具有强氧化性
B.铜和稀硝酸的反应属于置换反应
C.在铜与浓硝酸的反应中,硝酸只体现氧化性,没有体现酸性
D.可用铝或铁制容器盛装稀硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为硬脂酸甘油酯在碱性条件下水解的装置图,进行皂化反应时的步骤如下:
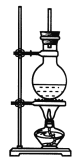
(1)在圆底烧瓶中加入7~8 g硬脂酸甘油酯,然后加入2~3 g的氢氧化钠、5 mL水和10 mL酒精,加入酒精的作用是________________________。
(2)隔着石棉网给反应混合物加热约10 min,皂化反应基本完成,所得的混合物为_____________(选填“悬浊液”、“乳浊液”、“溶液”或“胶体”)。
(3)向所得混合物中加入______________,静置一段时间后,溶液分为上下两层,肥皂在________层,这个操作称为____________。
(4)图中长玻璃导管的作用为__________________________。
(5)写出该反应的化学方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)BiCl3的水解产物中有BiOCl生成。
①写出BiCl3水解反应的方程式:_________________________。
②医药上将BiOCl称为次氯酸铋,该名称____________(填“正确”或“不正确”)。
③如何配制BiCl3溶液?_________________________________。
(2)将pH=2的某酸HnA与pH=12的某碱B(OH)m等体积混合后溶液的pH=8。
①若生成的盐中只有一种离子水解,该离子水解的离子方程式为_____________________。
②简述该混合液呈碱性的原因______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,8.96L的CH4具有的电子数(用NA代表阿伏加德罗常数的值)( )
A. 0.4NA B. 4NA C. 10NA D. 6.4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com