
| A.HN3水溶液中粒子浓度大小顺序为:c(HN3)>c(H+)>c(N3-)>c(OH-) |
| B.若HN3比HCN酸性强,则相同体积相同物质的量浓度的NaN3与NaCN溶液中,离子总数NaN3比NaCN多 |
| C.NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3-)>c(OH-)>c(H+) |
| D.HN3与NH3作用生成的叠氮酸铵是共价化合物 |


 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案科目:高中化学 来源:不详 题型:单选题
| A.若温度升高则平衡常数一定增大 |
| B.随温度的升高,碳酸钠溶液的pH减小 |
| C.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 |
| D.c(H+)/c(OH-)=1012的水溶液中:NH4+、Al3+、NO3-、Cl-能大量共存 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.C(s) + O2 (g) |
| B.C(s) + O2 (g) |
| C.C + O2 |
| D.C(s) + O2 (g) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
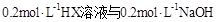 溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则下列说法(或关系式)正确的是
溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则下列说法(或关系式)正确的是A.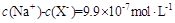 |
B.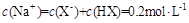 |
C.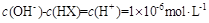 |
D.混合溶液中由水电离出的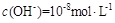 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溶液中的c(CH3COO-) | B.溶液中的c(H+) |
| C.溶液中的c(CH3COOH) | D.溶液中的c(OH-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.50 | 25.40 |
| 第二次 | 20.00 | 4.00 | 29.10 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.乙酸溶液的导电性比盐酸溶液的弱 |
| B.0.1mol/L乙酸钠溶液的pH约为8 |
| C.把0.1mol/L乙酸溶液温度升高10℃后(不考虑水蒸发),其 pH降低 |
| D.等浓度等体积的乙酸和盐酸在开始与同样大小的镁反应时,盐酸反应快 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
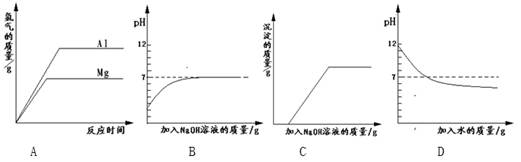
| A.将等质量的镁和铝分别与足量的盐酸反应 |
| B.向pH=2的盐酸中滴加过量的氢氧化钠溶液 |
| C.向盐酸和氯化铁的混合溶液中加入过量的氢氧化钠溶液 |
| D.向pH=12的氢氧化钠溶液中加水稀释 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com