
|
下列物质在水中部分电离且属于电解质的是 | |
A. |
NaOH |
B. |
CH3COOH |
C. |
H2SO4 |
D. |
CO2 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
| 元 素 | M | F | |
| 电能 (kJ?mol-1) |
I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 以任意比互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||


查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:2010年北京市朝阳区高三第二次模拟考试(理综)化学部分 题型:填空题
(14分)
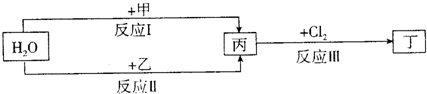
在下列物质转化关系中,反应的条件和部分产物已略去。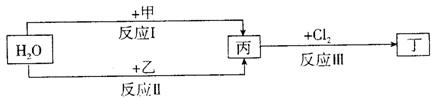
回答下列问题:
(1)若甲、乙是两种常见金属,反应Ⅲ是工业制盐酸的反应。
①反应I中,甲在通常条件下和水剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,则工业上生产甲的一般方法是 。
A.热分解法 B.热还原法 C.电解法
②反应Ⅱ中,乙与H2O在高温下反应,除丙外,还生成一种有磁性的物质,则反应Ⅱ的化学方程式是 。
③通过比较反应I、Ⅱ的反应条件,可得出甲的金属性比乙的金属性 (填 “强”或“弱”),比较二者金属性强弱的依据还可以是 (写出一种即可)。
(2)若甲、乙是化合物,且反应Ⅲ是工业制漂白粉的反应。
①反应Ⅲ的化学方程式是 。
②反应I的另一种产物为有机物,则该有机物的电子式是 。
③反应Ⅱ是化合反应。乙可与硫酸铵共热反应制氨气,则此反应的化学方程式是
。
④在饱和氯水中加块状石灰石,能制得较浓HCIO溶液,同时放出一种气体。其反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源:2010年北京市朝阳区高三第二次模拟考试(理综)化学部分 题型:填空题
(14分)
在下列物质转化关系中,反应的条件和部分产物已略去。

回答下列问题:
(1)若甲、乙是两种常见金属,反应Ⅲ是工业制盐酸的反应。
①反应I中,甲在通常条件下和水剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,则工业上生产甲的一般方法是 。
A.热分解法 B.热还原法 C.电解法
②反应Ⅱ中,乙与H2O在高温下反应,除丙外,还生成一种有磁性的物质,则反应Ⅱ的化学方程式是 。
③通过比较反应I、Ⅱ的反应条件,可得出甲的金属性比乙的金属性 (填 “强”或“弱”),比较二者金属性强弱的依据还可以是 (写出一种即可)。
(2)若甲、乙是化合物,且反应Ⅲ是工业制漂白粉的反应。
①反应Ⅲ的化学方程式是 。
②反应I的另一种产物为有机物,则该有机物的电子式是 。
③反应Ⅱ是化合反应。乙可与硫酸铵共热反应制氨气,则此反应的化学方程式是
。
④在饱和氯水中加块状石灰石,能制得较浓HCIO溶液,同时放出一种气体。其反应的离子方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com