
下列叙述正确的是
A.FeCl3溶液中加入镁粉有气泡产生
B.C12、SO2均能使品红溶液褪色,说明二者均有漂白性
C.铅蓄电池在放电过程中,负极质量减小,正极质量增加
D.向饱和NaC1溶液中先通入足量CO2,再通入足量NH3,可析出NaHCO3晶体
科目:高中化学 来源:2013-2014山东省兰陵县下学期期中考试高二化学试卷(解析版) 题型:填空题
(8分)下列各组中的两种有机物,可能是相同的物质、同系物或同分异构体等,请判断它们之间的关系
(1)2-甲基丁烷和丁烷 ________________
(2)正戊烷和2,2-二甲基丙烷___________________
(3)间二甲苯和乙苯_____________________
(4)1-已烯和环已烷_________________
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省乳山市下学期期中考试高一化学试卷(解析版) 题型:简答题
(9分)下图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。
请回答下列问题:

(1)当电极a为Al,电极b为Cu,电解质溶液为稀硫酸时,正极的电极反应式为: 。
(2)当电极a为Al,电极b为Mg,电解质溶液为氢氧化钠溶液时,该装置
(填“能”或“不能”)形成原电池,若不能,请说明理由;若能,请指出正、负极材料: 。当反应中收集到标准状况下224mL气体时,消耗的电极质量为 g。
(3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所产生的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,甲烷为燃料,采用氢氧化钠溶液为电解液;则甲烷应通入 极(填a或b,下同),电子从 极流出,电解质溶液中OH-向  极移动。
极移动。
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省乳山市下学期期中考试高一化学试卷(解析版) 题型:选择题
关于原子或离子结构的下列说法不正确的是
A.某原子K层上只有一个电子
B.某原子M层上电子数为L层上电子数的4倍
C.某离子M层上和L层上的电子数均为K层的4倍
D.某离子核电荷数与最外层电子数相等
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省临沂市高三三模试卷理科综合化学试卷(解析版) 题型:填空题
(18分)MnO2和Zn是制造干电池的重要原料,工业上用软锰矿(主要成分MnO2)和闪锌矿(主要成分ZnS)联合生产MnO2和Zn的工艺流程如下图所示:

(1)操作I用到硅酸盐材质的仪器有烧杯、玻璃棒和_______ _____(填仪器名称)。
(2)稀硫酸浸泡时反应的离子方程式为_______________________________________;该反应中若析出19.2g单质A,共转移____________mo1电子。浸泡时反应速率较慢,下列措施不能提高浸泡时反应速率的是________(填代号)。
a.将矿石粉碎
b.提高浸泡温度
c.适当增大硫酸浓度
d.改变软锰矿与闪锌矿的比例
(3)由硫酸锰溶液可得到固体碳酸锰,然后在空气中煅烧碳酸锰制备MnO2。已知:
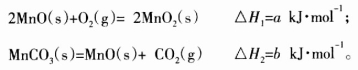
写出碳酸锰在空气中煅烧生成MnO2的热化学方程式_________________________。
(4)用惰性电极电解硫酸酸化的硫酸锰溶液制备MnO2的装置如下图所示:
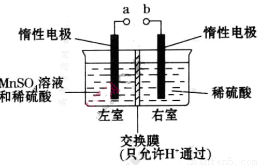
①a应与直流电源的_________(填“正”或“负”)极相连。.
②电解过程中氢离子的作用是______________和_____________;若转移的电子数为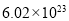 个,左室溶液中
个,左室溶液中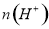 的变化量为________________。
的变化量为________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省临沂市高三5月二模理综化学试卷(解析版) 题型:填空题
(12分)【化学一物质结构与性质】
已知A、B、C、D均为前四周期元素且原子序数依次增大,元素A的基态原子2p轨道有3个未成对电子,元素B的原子最外层电子数是其内层电子数的3倍,元素C的一种常见单质为淡黄色粉末,D的内层轨道全部排满电子,且最外层电子数为l。
(1)在第2周期中,第一电离能大于B的元素有____种。
(2)A的最简单气态氢化物分子的空间构型为________;H2B在乙醇中的溶解度大于H2C,其原因是_______。
(3)AB3,中,A原子轨道的杂化类型是_______ ,与AB3互为等电子体微粒的化学式
为________(写出一种即可)。
(4)D(OH)2难溶于水,易溶于氨水,写出其溶于氨水的离子方程
式_______.
( 5)D2B的晶胞如图所示,已知晶体的密度为  ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则晶胞边长为_______cm(用含
,则晶胞边长为_______cm(用含  、
、 的式子表示)。
的式子表示)。

查看答案和解析>>
科目:高中化学 来源:2013-2014山东省临沂市高三5月二模理综化学试卷(解析版) 题型:选择题
某有机物的结构简式如图所示,下列有关该有机物的说法正确的是
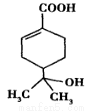
A.分子中含有两种官能团
B.可使溴水和酸性高锰酸钾溶液褪色,且原理相同
C.能发生加成、取代、氧化等反应
D.与钠和氢氧化钠溶液都能发生反应,且得到的产物相同
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省下学期高二期末化学模拟试卷(解析版) 题型:选择题
已知胰岛素含硫的质量分数为3.4%,相对分子质量为5734,则每个胰岛素分子中所含的硫原子数为
A.2 B.4 C.6 D.8
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省皖南八校高三第三次联考理综化学试卷(解析版) 题型:实验题
(14分)锰锌软磁铁氧体具有高磁导率、低矫顽力和低功率损耗等性能,已广泛应用于电子工业。碳酸锰主要用于制备锰锌软磁铁氧体,而制碳酸锰的原料之一是二氧化锰。某化学研究性学习小组拟从废旧干电池中回收二氧化锰制取碳酸锰。
①将干电池剖切、分选得到黑色混合物(主要成分为MnO2)洗涤、过滤、烘干。
②将上述固体按固液体积比2:9加入浓盐酸、加热,反应完全后过滤、浓缩。
③向上述溶液中加入Na2CO3溶液,边加边搅拌,再过滤即可得到碳酸锰。
(l)在第②步中,将上述固体与浓盐酸混合的目的是
(2)有人认为,将第③步中的Na2CO3溶液换成NH4HCO3溶液,也能达到上述目的,但同时有气体生成。请写出加入NH4HCO3溶液时发生的离子反应方程式 。
(3)查阅文献,发现第③步中,除生成MnCO3外还有可能生成Mn(OH)2,已知Mn(OH)2暴露在空气中时间稍长,易被氧化成褐色的MnO(OH)2, MnCO3和MnO(OH)2受热最终均分解成MnO2,该小组对上述沉淀的成分提出以下假设,请帮助完成假设:
假设一:全部为MnCO3; 假设二:全部为Mn(OH)2; 假设三:
为验证假设二是否正确,该小组进行了以下研究:
①定性研究:请你完成下表中的内容.
实验步骤(不要求写出具体步骤) | 预期的实验现象和结论 |
将所得沉淀过滤、洗涤,
|
|
|
|
②定量研究:将所得沉淀过滤、洗涤,置于空气中充分氧化后,小心干燥,取22.0g样品,加热,测得固体质量随温度的变化关系如图.根据图中的数据判断假设三成立,理由是 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com