
分析 平衡常数等于生成物的浓度幂之比除以反应物的浓度幂之积,则H2CO3?HCO3-+H+的平衡常数K1=$\frac{c({H}^{+})•c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$,据此进行解答.
解答 解:常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H+)=c(HCO3-)=10-5.6mol/L;c(H2CO3)=1.5×10-5 mol•L-1,若忽略水的电离及H2CO3的第二级电离,则H2CO3的第一级电离的平衡常数K1=$\frac{c({H}^{+})•c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$=$\frac{1{0}^{-5.6}×1{0}^{-5.6}}{1.5×1{0}^{-5}}$=4.2×10-7 mol•L-1,
故答案为:4.2×10-7 mol•L-1.
点评 本题考查了化学平衡的计算,题目难度不大,明确化学平衡常数的概念及表达式即可解答,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:实验题
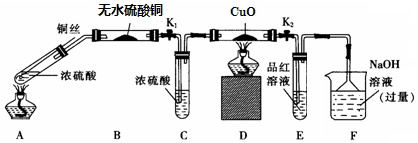
| 硫酸/mol•L-1 | 黑色物质出现的温度/℃ | 黑色物质消失的温度/℃ |
| 14 | Cu 片表面无明显现象 | |
| 15 | 约150 | 约236 |
| 16 | 约140 | 约250 |
| 18 | 约120 | 不消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C、D、E五种元素中只有E为金属元素,五种元素的原子叙述按B、D、C、A、E的顺序依次增大,D、C元素在元素周期表中位置相邻,在一定条件下,B的单质可以分别和A、.C、D的单质化合生成甲、乙、丙化合物,C的单质和D的单质化合物可得丁,戊、己、庚均为化合物.已知乙、丙每个分子中均含有10个电子,图为相互转化关系.
A、B、C、D、E五种元素中只有E为金属元素,五种元素的原子叙述按B、D、C、A、E的顺序依次增大,D、C元素在元素周期表中位置相邻,在一定条件下,B的单质可以分别和A、.C、D的单质化合生成甲、乙、丙化合物,C的单质和D的单质化合物可得丁,戊、己、庚均为化合物.已知乙、丙每个分子中均含有10个电子,图为相互转化关系. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| B. | 钠与CuSO4溶液反应:2Na+Cu2+═Cu↓+2Na+ | |
| C. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | Ba(OH)2溶液与稀H2SO4反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图是我校化学实验室浓盐酸试剂标签上的部分内容.
如图是我校化学实验室浓盐酸试剂标签上的部分内容.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
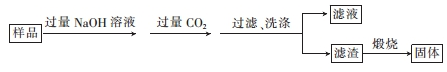
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一电离能:Y<X | |
| B. | 最简单气态氢化物的稳定性:HmY>HnX | |
| C. | 最高价含氧酸的酸性:元素X对应酸的酸性强于Y | |
| D. | X和Y形成的化合物中,X显负价,Y显正价 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
在容积为 1L的密闭容器中充入1mol CO和2mol H2混合气体,发生以下反应:CO(g)+2H2(g) CH3OH(g)。T1、T2温度下,CH3OH的物质的量随着时间的变化关系如下图所示。下列有关说法正确的是
CH3OH(g)。T1、T2温度下,CH3OH的物质的量随着时间的变化关系如下图所示。下列有关说法正确的是
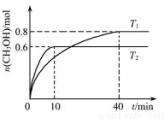
A.T1>T2
B.K(T1)>K(T2)
C. T1温度下达到平衡后,再充入一定量CO,CO的转化率增大
T1温度下达到平衡后,再充入一定量CO,CO的转化率增大
D.T2温度下,0~10min间v(H2)=0.06mol·L-1·min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com