
| A. | 温度 | B. | 反应物的性质 | C. | 浓度 | D. | 催化剂 |
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 150 mL 1 mol•L-1 NaCl溶液 | B. | 75 mL 2 mol•L-1CaCl2溶液 | ||
| C. | 150 mL 2 mol•L-1 KCl溶液 | D. | 75 mL 1 mol•L-1AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
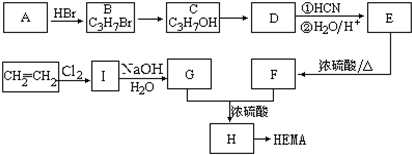
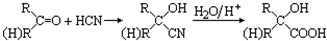
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠投入水中:Na+H2O═Na++OH-+H2↑ | |
| B. | 足量铁加入少量稀硝酸中:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| C. | 向硫酸铝铵[NH4Al(SO4)2]溶液中滴加少量Ba(OH)2溶液NH4++Al3++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3•H2O+2H2O | |
| D. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2[Ag(NH3)2]++2OH-$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 次数 | 1 | 2 | 3 |
| 滴定体积/mL | 19.98 | 20.02 | 19.00 |
| 实验编号 | 实验操作 | 现象 |
| 1 | 向10mL 3mol/L KNO3酸性溶液(pH=1)中插入一根洁净的Ag丝,并滴加NaCl溶液 | 无白色沉淀生成 |
| 2 | 向10mL 1mol/L AgNO3溶液中滴加2mL 0.1mol/L FeSO4溶液,振荡,再滴加酸性KMnO4溶液 | 紫红色不褪去 |
| 3 | 向10mL 1mol/L Fe(NO3)3酸性溶液(pH=1)中插入一根洁净的Ag丝,并滴加NaCl溶液 | 有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H6 | B. | C2H6O | C. | C2H4O | D. | C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.05 mol•L-1 | B. | 0.1 mol•L-1 | C. | 0.2 mol•L-1 | D. | 0.3 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-4 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤⑧ | B. | ④⑤⑦ | C. | ③⑤⑦ | D. | ③④⑤⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com