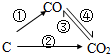
由碳元素构成的各种单质和化合物始终都是科学家研究的重要对象.
(1)如图为碳及其氧化物的变化关系图,若①变化是置换反应则其化学方程式可为(写一个即可)
;图中变化过程哪些是吸热反应
(填序号).
(2)汽车尾气中的一氧化碳是大气污染物,可通过反应:CO(g)+
O
2(g)?CO
2(g)降低其浓度.某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示.请填写表中的空格.
| 容器编号 | c(CO)/mol?L-1 | c(O2)/mol?L-1 | c(CO2)/mol?L-1 | v(正)和v(逆)比较 |
| Ⅰ | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | v(正)=v(逆) |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 | v(正) v(逆) |
(3)CCS 技术是将工业和有关能源产业中所生产的CO
2进行捕捉与封存的技术,被认为是拯救地球、应对全球气候变化最重要的手段之一.其中一种以天燃气为燃料的“燃烧前捕获系统”的简单流程图如下所示(部分条件及物质未标出).回答下列问题:

CH
4在催化剂作用下实现第一步,也叫CH
4不完全燃烧,1gCH
4不完全燃烧反应放出2.21kJ热量,写出该反应的热化学方程式
.
(4)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用(4)转化中得到的合成气制备甲醇.反应为CO(g)+2H
2(g)?CH
3OH(g) 某温度下,在容积为2L的密闭容器中进行该反应,其相关数据见下图:
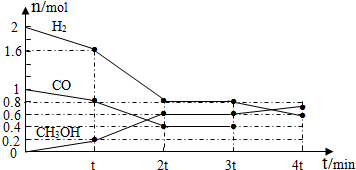
据上图计算,从反应开始到t min时,用H
2浓度变化表示的平均反应速率v(H
2)=
②t mi至2t min时速率变化的原因可能是
;
③3t min时对反应体系采取了一个措施,至4t min时CO的物质的量为0.5mol,请完成上图CO的曲线.
(5)某同学按下图所示的装置用甲醇燃料电池(装置I)进行电解的相关操作,以测定铜的相对原子质量,其中c电极为铜棒,d电极为石墨,X溶液为500mL 0.4mol/L硫酸铜溶、液.当装置II中某电极上收集到标准状况下的气体V
1mL时,另一电极增重mg(m<12.8).
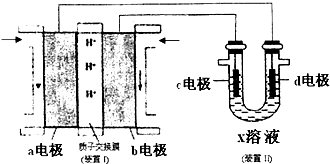
①装置I中、H
+向
极(填“a”或“b”)移动;b电极上发生的反应为
.
②铜的相对原子质量的表达式为
(用m和V
1的代数式表示).

 全能测控期末小状元系列答案
全能测控期末小状元系列答案 由碳元素构成的各种单质和化合物始终都是科学家研究的重要对象.
由碳元素构成的各种单质和化合物始终都是科学家研究的重要对象.

