
【题目】下图是A、B、C.D、E、F等几种常见有机物之间的转化关系图,其中A是面粉的主要成分;C和E反应能生成F,F具有香味,B与E的实验式相同。
![]()
根据以上信息及各物质的转化关系完成下列各题:
(1)B的化学式为____________, C中所含官能团名称__________, 与B同分异构体的一种物质的名称_____________。
(2)其中能与新制氢氧化铜悬浊液在加热煮沸条件下能产生砖红色的沉定的物质有_______(填名称)
(3)写出C→D的化学方程式___________________________________________
(4)写出C+E→F的化学方程式_________________________________________
【答案】C6H12O6羟基果糖葡萄糖、乙醛![]()
【解析】
A是面粉中的主要成分,则A为淀粉,化学式为:(C6H10O5)n;A充分水解得B发酵得C、C氧化生成D,D能与新制的Cu(OH)2反应产生砖红色沉淀,则D中含有醛基,所以B为葡萄糖:CH2OH(CHOH)4CHO,葡萄糖发酵生成乙醇,则C为乙醇,乙醇氧化生成乙醛,则D为乙醛,乙醛氧化生成乙酸,则E为乙酸,符合B与E的实验式相同的条件,乙酸与乙醇发生正反应生成F,则F为乙酸乙酯,据此分析可得结论。
(1)根据分析可知, B为葡萄糖,分子式为:C6H12O6,C为乙醇,官能团为羟基,果糖为B的同分异构体,故答案为:C6H12O6、羟基、果糖;
(2)能够与新制Cu(OH)2反应产生砖红色沉淀的物质中一定含有醛基,A到F中含有醛基的为葡萄糖和乙醛,故答案为:葡萄糖和乙醛;
(3)C→D的转化为乙醇的催化氧化,反应方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
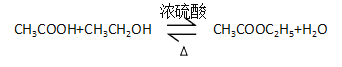
(4)C+E→F的转化为乙醇和乙酸的酯化反应,方程式为: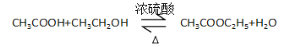 ;故答案为:
;故答案为: 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写正确的是
A. 食醋除去瓶胆内的水垢:CaCO3+2H+===Ca2++CO2↑+H2O
B. 漂白粉溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO
C. Al溶于NaOH溶液:2Al+2OH-+2H2O===2 AlO+3H2↑
D. 用惰性电极电解硫酸铜溶液:2Cu2++4OH-![]() 2Cu+O2↑+2H2O
2Cu+O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学常见物质A、B、C、D、E、X,存在下图转化关系(部分生成物和反应条件已略去)。下列推断错误的是
![]()
A. 若D为NaCl,且A可与C反应生成B,则E可能是CO2
B. 若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁
C. 若D是一种强碱,则A.B.C均可与X反应生成D
D. 若D是一种强酸,则A 既可是单质也可是化合物,且D 可与铜反应生成B或C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子核磁共振谱(NMR)是研究有机化合物结构的有力手段之一。在所研究化合物的分子中,每一结构中的等性氢原子,在NMR谱中都给出相应的峰(信号)。谱中峰的强度与结构中的H原子数成正比。例如,乙醛的结构式为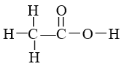 ,其NMR谱中有两个信号,其强度之比为3∶1。
,其NMR谱中有两个信号,其强度之比为3∶1。
(1)分子式为C3H6O2的二元混合物,如果在NMR谱中观察氢原子给出的峰有两种情况:第一种情况峰的强度比为3∶3;第二种情况峰的强度比为3∶2∶1。由此可推断该混合物的组成可能是(写结构简式)_____________________。
(2)在测得的CH3CH2CH2CI化合物的.NMR谱上可观察到三种峰,而测定化合物CH3CH=CHCl时,却得到氢原子给出的6个信号峰。根据原子空间排列方式不同,试写出CH3CH=CHCl分子的空间异构____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在150 ℃的条件下,总质量为3 g的一氧化碳和氢气的混合气体,在足量的氧气中燃烧后,再通过足量的过氧化钠,过氧化钠增加的质量为( )
A.1.5 gB.3 gC.6 gD.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们对苯的认识有一个不断深化的过程。已知分子式为 C6H6的结构有多种,其中的两种为:
Ⅰ.![]() Ⅱ.
Ⅱ.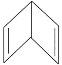
(1)这两种结构的化学性质区别表现在:Ⅰ能________(填字母,下同),而Ⅱ能________。
A.被酸性KMnO4溶液氧化
B.与溴水发生加成反应
C.与氢气发生加成反应
(2)1 mol C6H6与H2发生完全加成反应,Ⅰ需________molH2,而Ⅱ需________mol H2。
(3)今发现C6H6还可能有另一种如下图所示的立体结构,该结构的二氯代物有_________种。
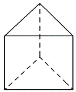
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.A、B、C、D和E均为中学化学常见的纯净物,其中B为自然界中含量最多的液体,它们之间有如图反应关系:

(1)若A的溶液能使淀粉溶液变蓝,C为非金属氧化物,能使品红溶液褪色,该反应的离子方程式为____________________________________。
(2)若A为短周期的金属单质,D为气态单质,C溶液呈强酸性或强碱性时,该反应都能进行。写出C溶液呈强碱性时反应的离子方程式:_____________________________。
(3)若A、C均为化合物,E为白色沉淀(不含金属元素),C为引起温室效应的主要气体,则该反应的离子方程式为__________________________________。
Ⅱ. FeCl3可用于污水处理,具有效果好、价格便宜等优点。工业上可将铁屑溶于盐酸中先生成FeCl2,再通入Cl2氧化来制备FeCl3溶液。
(4)将标准状况下a L氯化氢气体溶于1000g水中得到盐酸,若该盐酸的密度为b g·mL-1,则该盐酸的物质的量浓度是____________________。
(5)向100 mL的FeBr2溶液中通入标准状况下Cl2 3.36 L,反应后的溶液中Cl-和Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为____________。
(6)用100 mL 2 mol·L-1的FeCl3溶液净水时,生成具有净水作用的微粒数_____0.2NA (填“大于”“等于”或“小于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式,正确的是( )
A. 甲烷的燃烧热ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为 CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
D. 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com