
设NA为阿伏加德罗常数,下列说法正确的是( )
A. 标准状况下,5.6 L四氯化碳含有的分子数为0.25NA
B. 标准状况下,14 g氮气含有的核外电子数为5NA
C. 标准状况下,22.4 L任意比的氢气和氯气的混合气体中含有的分子总数均为NA
D. 标准状况下,铝跟氢氧化钠溶液反应生成1 mol氢气时,转移的电子数为NA
考点: 阿伏加德罗常数.
分析: A、根据标准状况下四氯化碳不是气体进行判断;
B、排除干扰条件,根据氮气的质量计算出氮气的物质的量及含有的核外电子数;
C、根据标准状况下气体摩尔体积计算出混合气体的物质的量及分子数;
D、根据电子转移计算出生成1mol氢气转移的电子数目.
解答: 解:A、标准状况下四氯化碳不是气体,无法计算5.6L四氯化碳的物质的量,故A错误;
B、14g氮气的物质的量为0.5mol,含有7mol核外电子,含有的核外电子数为7NA,故B错误;
C、标准状况下,气体摩尔体积为22.4L/mol,所以22.4 L任意比的氢气和氯气的混合气体的物质的量为1mol,含有的分子总数均为NA,故C正确;
D、生成1mol氢气,需要得到2mol电子,转移的电子数为2NA,故D错误;
故选:C.
点评: 本题考查了阿伏伽德罗常数,题目难度不大,注意标准状况下四氯化碳不是气体,熟练掌握物质的量与阿伏伽德罗常数、气体摩尔体积、摩尔质量间关系.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
下列图示与对应的叙述相符的是( )
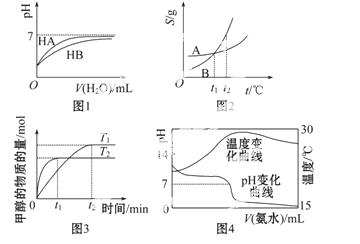
A.图1表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH
B.图2表示A、B两物质的溶解度随温度变化情况,将t1 ℃时A、B的饱和溶液分别升温至t2 ℃时,溶质的质量分数 B>A
C.图3表示在其他条件相同时,分别在T1、T2温度下由CO2和H2合成甲醇的物质的量随时间变化情况,则CO2和H2合成甲醇是吸热反应
D.图4表示将1.000 mol·L-1氨水滴入20.00 mL 1.000 mol·L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
化学实验中,如果使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如:
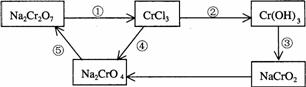
(1)在上述有编号的步骤中,需用还原剂的是 ,需用氧化剂的是 。(填编号)
(2)在 K2Cr2O7 + 14HCl ==== 2KCl + 2CrCl3 + 3Cl2↑+ 7H2
==== 2KCl + 2CrCl3 + 3Cl2↑+ 7H2 O反应中, 元素被氧化,
O反应中, 元素被氧化,
是氧化剂;并用双线桥表明电子转移方向与数目: 。
(3)在(2)的反应中,盐酸的作用: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W、U是分别位于短周期的元素,原子序数依次递增.X与W位于同一主族,Z元素的单质既能与盐酸反应也能与NaOH溶液反应,W原子的最外层电子数是次外层电子数的一半,Z、W、U原子的最外层电子数之和为13.Y元素的单质在X的某种氧化物中可燃.下列说法正确的是( )
|
| A. | W的最高价氧化物能与水反应生成相应的酸 |
|
| B. | Y、Z元素的单质作电极,在NaOH溶液下构成原电池,Z电极上产生大量气泡 |
|
| C. | 室温下,0.05 mol/L U的气态氢化物的水溶液的pH>1 |
|
| D. | Y、Z、U元素的简单离子半径由大到小的顺序:Y>Z>U |
查看答案和解析>>
科目:高中化学 来源: 题型:
熔融盐燃料电池具有高的发电效率,因而受到重视.某燃料电池以熔融的K2CO3为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.
该燃料电池负极电极反应式为 ;
该燃料电池正极电极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列变化:①导电、②爆炸、③缓慢氧化、④变色、⑤无水硫酸铜吸水、⑥工业制氧气、⑦白磷变成红磷、⑧久置浓HNO3变黄,一定属于化学变化的是( )
|
| A. | ①④ | B. | ⑥⑧ | C. | ②⑥⑦ | D. | ③⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
把2.1g的CO与H2组成的混合气体与足量的O2充分燃烧后,立即通入足量的Na2O2固体中,固体的质量增加( )
|
| A. | 7.2g | B. | 3.6g | C. | 2.1g | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
过滤后的食盐水仍含有可溶性的Ca2+,Mg2+,SO42- 杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;
③加入稍过量的BaCl2 溶液;④滴入稀盐酸至无气泡产生;⑤过滤。
正确的操作顺序是( )
A.③②①⑤④ B.①②③⑤④ C.②③①④⑤ D.③⑤②①④
查看答案和解析>>
科目:高中化学 来源: 题型:
6.5g的锌和足量的盐酸反应。
(1)计算产生的气体在标准状况下的体积 L。(不必写出计算过程)(3分)
(2)计算反应过程中转移电子的物质的量。(写出计算过程)(4分)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com