
【题目】现有下列5种有机物:
① HCOOCH3 ② CH3COOH ③ CH3—CH=CH2 ④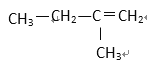 ⑤
⑤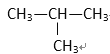
(1) 其中符合通式CnH2n+2的是________ ( 填序号,下同 ), 与 ①互为同分异构体的是_________,与 ③ 互为同系物的是___________
(2) 用系统命名法给 ⑤ 命名,其名称为 _________________
科目:高中化学 来源: 题型:
【题目】某研究性学习组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:(已知H2C2O4是弱酸)
实验 序号 | 实验 温度 | KMnO4溶液 | H2C2O4溶液 | H2O | 溶液褪色时间 | ||
V(mL) | c(mol/L) | V(mL) | c(mol/L) | V(mL) | t(s) | ||
A | 293K | 2 | 0.05 | 8 | 0.25 | 0 | t1 |
B | T1 | 2 | 0.05 | 6 | 0.25 | V1 | 8 |
C | 313K | 2 | 0.05 | 6 | 0.25 | 2 | t2 |
(1)通过实验A、B,可探究出___的改变对反应速率的影响,其中
(2)通过实验____可探究出温度变化对化学反应速率的影响。
(3)若t1<8,则由实验A、B可以得出的结论是____;利用实验B中数据计算,从反应开始到有结束,用KMnO4的浓度变化表示的反应速率为______。
(4)该反应中有无色无味气体产生,且锰被还原为Mn2+,写出相应反应的离子方程式 ________。
(5)该小组的一位同学通过查阅资料发现:反应一段时间后该反应速率会加快,造成此种变化的原因是反应体系中的某种粒子对KMnO4与H2C2O4之间的反应有某种特殊的作用,则该作用是 ____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。
已知:①CO的燃烧热△H1=-283kJmol-1
②N2(g)+O2(g)2NO(g) △H2=+183kJmol-1
则写出CO和NO反应生成无污染气体的热化学反应方程式________ 。
(2)一定压强下,在容积为2L的密闭容器中充入1molCO与2molH2,在催化剂作用下发生反应:CO(g)+2H2(g)CH3OH(g) △H ,CO转化率与温度和压强的关系如下图所示。
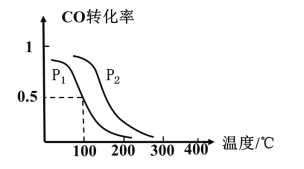
①反应的△H____ 0 ,p1___ p2(填>、< 或=)
②100℃时,反应进行了10秒达到平衡状态,用CO表示该反应的化学反应速率是______ ,该反应的化学平衡常数K=____ 。
③下列说法正确的是______。
A.若容器内气体密度恒定,反应达到平衡状态 B.若容器内各气体浓度恒定,反应达到平衡状态
C.上述反应中,△H>0 D.反应中,催化剂使平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是极易溶于水且不与水发生化学反应的黄绿色气体,沸点为11℃,可用于处理部分含硫废水。某小组在实验室中利用下列装置制备ClO2(此制备方法中经空气稀释的SO2与ClO2不反应)。
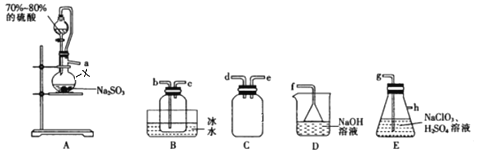
回答下列问题:
(1)仪器X的名称是__________________________。
(2)欲选择上图中的装置收集ClO2,其连接顺序为a→______(按气流方向,用小写字母表示)。
(3)装置C的作用是_________,装置E中反应的离子方程式为__________________________________。
(4)处理含硫(Na2S)碱性废水时,ClO2与Na2S反应(S2-被氧化为SO42-)的离子方程式为_________________;处理含硫碱性废水时,相同条件下同体积的ClO2相对于Cl2的优点是______________________________。
(5)ClO2很不稳定,需现用现配,为测定所得溶液中ClO2的含量,进行下列实验:
步骤1:准确量取V1 mL ClO2溶液加入锥形瓶中。
步骤2:用稀硫酸调节ClO2溶液的pH≤2.0,再加入足量KI晶体,静置片刻。
步骤3:加入指示剂,用c mol·L-1的Na2S2O3标准溶液滴定至终点时,消耗V2 mL Na2S2O3标准溶液。
(已知:2ClO2+8H++10I-===2C1-+5I2+4H2O;2S2O32-+I2===2I-+S4O62-)原溶液中ClO2的含量为____________(用含c、V1、V2的代数式表示)g·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
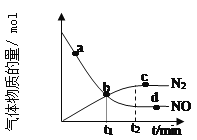
【题目】(1)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的 NO 和 NH3,在 一定条件下发生反应:6NO(g) + 4NH3(g)![]() 5N2(g) +6H2O(g)。
5N2(g) +6H2O(g)。
①能说明该反应已达到平衡状态的标志是 ___________
a.反应速率 v( NH3) =v( N2)
b.容器内压强不再随时间而发生变化
c.容器内 N2 的物质的量分数不再随时间而发生变化
d.容器内 n(NO)∶n(NH3)∶n(N2)∶n(H2O) = 6∶4∶5∶6
e.12molN-H 键断裂的同时生成 5mol N≡N 键
f.混合气体的总质量不随时间的变化而变化
②某次实验中测得容器内 NO 及 N2 的物质的量随时间变化如图所示,图中 b 点 对应的速率关系是v(正) ___________ v(逆)(填﹥、﹤或﹦),d 点对应的速率关系是v(正) ___________ v(逆)
(填﹥、﹤或﹦)。
(2)298 K 时,若已知生成标准状况下 2.24LNH3时放出热量为 4.62kJ。写出合成氨反应的热化学方程式___________。在该温度下,取 1molN2和 3mol H2 放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量总小于 92.4 kJ, 其原因是___________。
(3)一定条件下,在 2L密闭容器内,反应 2NO2(g)![]() N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)随时间变化如下表:
N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)随时间变化如下表:
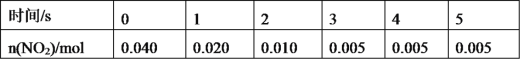
①用 N2O4 表示 0~2 s 内该反应的平均速率为__________。在第 5s 时,NO2 的转化 率为____________。(转化率是指某一反应物转化的百分率。)
②根据上表可以看出,随着反应进行,反应速率逐渐减小,其原因是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.用系统命名法命名有机物![]() 和
和 主链碳原子数均为7个
主链碳原子数均为7个
B.某烃的分子式为C10H14,它不能使溴水褪色,但可使酸性KMnO4溶液褪色,且分子结构中只有一个烷基,符合条件的烃有4种
C.碳原子数小于或等于8的单烯烃中,与HBr加成产物只有一种结构,符合条件的单烯烃有6种
D.苯甲醛分子中所有的原子不一定共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤代烃与金属镁在无水乙醚中反应,可得格氏试剂 R—MgX,它可与醛、酮等羰基化合物加成,所得产物经水解可以得到醇,这是某些复杂醇的合成方法之一。现欲合成(CH3)3C—OH,下列所选用的卤代烃和羰基化合物的组合正确的是 ( )
![]() →
→![]() H
H
A. 甲醛和 1-溴丙烷B. 丙酮和一氯甲烷C. 乙醛和氯乙烷D. 甲醛和2-溴丙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某绿色溶液A含有H+、Na+、Mg2+、Fe2+、Cu2+、SO42-、Clˉ、CO32-和HCO3-离子中的若干种。取该溶液进行如下实验(已知Ag2SO4微溶于水,可溶于酸):①向溶液中滴加少量Ba(OH)2溶液,过滤,得到不溶于酸的白色沉淀和绿色滤液B;②取滤液B,先用HNO3酸化,再滴加0.001 mol·Lˉ1AgNO3溶液,有白色沉淀生成。下列说法不正确的是
A.溶液A中不存在Mg2+、CO32-和HCO3-,不能确定Na+的存在
B.溶液A中存在Fe2+与Cu2+中的一种或两种
C.第②步生成的白色沉淀中只有AgCl,没有Ag2CO3
D.溶液A中一定存在H+、SO42-和Clˉ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com