
| A. | 只有②③④ | B. | 只有④ | C. | 只有③④ | D. | 全部 |
分析 ①浓硫酸具有吸水性、浓盐酸具有挥发性;
②二氧化硫能和有色物质反应生成无色物质,次氯酸具有强氧化性;
③二氧化硫能和有色物质反应生成无色物质,二氧化硫能被强氧化剂溴氧化;
④溴化氢和碘化氢气体均能被浓硫酸氧化;
⑤浓硫酸能将有机物中的H、O元素以2:1水的形式脱去,氢氟酸能和二氧化硅反应生成四氟化硅.
解答 解:①浓硫酸具有吸水性,能吸收空气中的水分而使其溶液浓度减小,浓盐酸具有挥发性,能挥发导致溶液浓度降低,所以二者原理不同,故错误;
②二氧化硫能和有色物质反应生成无色物质而体现漂白性,氯气和水反应生成的次氯酸具有强氧化性而体现漂白性,所以二者原理不同,故错误;
③二氧化硫能和有色物质反应生成无色物质而体现漂白性,二氧化硫能被强氧化剂溴氧化生成硫酸,溴被还原生成HBr,二氧化硫体现还原性,所以二者原理不同,故错误;
④溴化氢和碘化氢气体均能被浓硫酸氧化生成溴、碘,HBr、HI都体现还原性,故正确;
⑤浓硫酸能将有机物中的H、O元素以2:1水的形式脱去而体现脱水性,氢氟酸能和二氧化硅反应生成四氟化硅和水,氢氟酸体现酸性,所以二者原理不同,故错误;
故选B.
点评 本题考查物质之间的反应,明确反应原理是解本题关键,熟悉常见物质的性质,注意二氧化硫、次氯酸漂白原理的差别,二氧化硫不能漂白酸碱指示剂,为易错点.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:解答题
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 64.0 | 50.653 | 42.875 |
| A | B | C | D | |
| n(Fe2O3) | 0.350 | 0.027 | 0.080 | 0.080 |
| n(CO) | 0.010 | 0.010 | 0.010 | 0.050 |
| n(Fe) | 0.100 | 0.064 | 0.080 | 0.080 |
| n(CO2) | 0.035 | 0.088 | 0.040 | 0.050 |
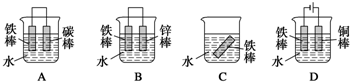
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18.4mol/L 硫酸 10mL | B. | 2mol/L 硫酸 10mL | ||
| C. | 1mol/L 硫酸 30mL | D. | 3mol/L 盐酸 10mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②③⑥ | C. | ③⑥ | D. | ③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤⑥ | B. | ②③⑤⑥ | C. | ②④⑤⑥ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
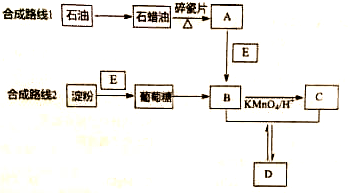
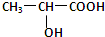 .9g乳酸与足量金属钠完全反应产生的气体在标准状况下的体积是22.4L,如果与足量的小苏打溶液完全反应产生的气体在标准状况下的体积是22.4L.
.9g乳酸与足量金属钠完全反应产生的气体在标准状况下的体积是22.4L,如果与足量的小苏打溶液完全反应产生的气体在标准状况下的体积是22.4L.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
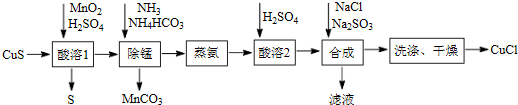
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com