
分析 (1)电解饱和食盐水生成氯气、氢气和氢氧化钠;
(2)根据阳极产物和平衡移动原理分析;
(3)在除杂的过程中每步加入的试剂必须是过量的,使离子除尽;过量的离子在下一步中必须出去,故先加入BaCl2,除去硫酸根,过量的钡离子,加入Na2CO3除去.根据提供的Ksp数据,在后面加入碳酸钠时,发生BaSO4(s)+CO32- (aq)=BaCO3(s)+SO42- (aq);
(4)NH4+被氧化生成NCl3,可据此书写电极方程式.
解答 解:(1)电解饱和食盐水生成氯气、氢气和氢氧化钠,方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;
(2)电解时用盐酸控制阳极区溶液的pH在2~3的作用是促使化学平衡Cl2+H2O?HCl+HClO向左移动,减少Cl2在水中的溶解,有利于Cl2的逸出,
故答案为:使氯气与水的反应(Cl2+H2O?HCl+HClO)平衡向右移动,减少氯气溶解;
(3)加入过量的Na2CO3和NaOH,可分别除去Ca2+、Mg2+,在除杂的过程中每步加入的试剂必须是过量的,使离子除尽;过量的离子在下一步中必须出去,故先加入BaCl2,除去硫酸根,过量的钡离子,加入Na2CO3除去.BaSO4和BaCO3的Ksp相差不大,当溶液中存在大量CO32-时,发生BaSO4(s)+CO32- (aq)=BaCO3(s)+SO42- (aq),BaSO4(s)会部分转化为BaCO3(s),
故答案为:BaCl2; Na2CO3;由于BaSO4和BaCO3的Ksp相差不大,当溶液中的CO32-较大时,BaSO4会部分转化为BaCO3;
(4)NH4+被氧化生成NCl3,电极方程式为NH4+-6e-+3Cl-=NCl3+4H+,故答案为:NH4+-6e-+3Cl-=NCl3+4H+.
点评 本题考查了海水资源的利用,提纯溴、镁的制备过程分析,该题侧重对学生基础知识的巩固与训练,同时也注重对学生答题能力的培养和方法指导,有利于培养学生的逻辑思维能力和发散思维能力,属于中等难度的试题,试题综合性强,注意把握电解原理以及电极方程式的书写,把握题给信息.


 每课必练系列答案
每课必练系列答案科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 纯净物 | 纯硫酸 | 冰醋酸 | 水玻璃 | 胆矾 |
| 混合物 | 水煤气 | 福尔马林 | 冰水混合物 | 漂白粉 |
| 弱电解质 | 氨水 | 氟化氢 | 氨 | 水 |
| 非电解质 | 干冰 | 乙醇 | 三氧化硫 | 氯气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
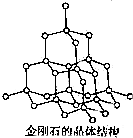 CH4、NH3、H20和HF均为含10e-的分子.
CH4、NH3、H20和HF均为含10e-的分子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x+y>3 | |
| B. | 反应速率加快,活化分子百分数增加 | |
| C. | A的转化率减小,体积分数增大 | |
| D. | 平衡正向移动,平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
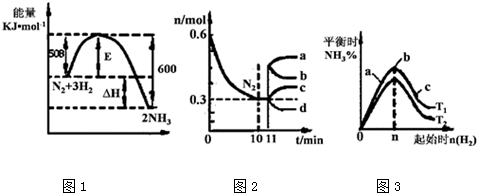
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13C与15N具有相同的中子数 | |
| B. | 0.012kg 13C所含的碳原子数为阿伏加德罗常数 | |
| C. | 等物质的量的13C17O和15N2,两气体具有相同的质子数、原子数和质量 | |
| D. | 13C、15N和C60、N70互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
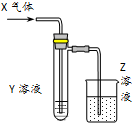 用以如图示装置研究物质的性质,能够获得可靠结论的是( )
用以如图示装置研究物质的性质,能够获得可靠结论的是( )| X | Y | Z | 结论 | |
| A | HCHO | 新制Cu(OH)2 | NaOH(aq) | 验证甲醛的还原性 |
| B | CH3Cl | AgNO3(aq) | NaOH(aq) | 验证一氯甲烷含氯元素 |
| C | SO2 | KMnO4(aq) | NaOH(aq) | 验证二氧化硫的漂白性 |
| D | Cl2 | 淀粉KI(aq) | NaOH(aq) | 验证氯气的强氧化性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
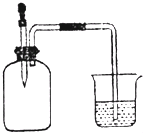
| A. | ①② | B. | ②③ | C. | ②④ | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com