
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=== CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+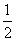 O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是( )。
A.CH3OH的燃烧热为192.9 kJ·mol-1
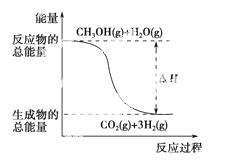
B.反应①中的能量变化如下图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应CH3OH(l)+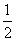 O2(g)===CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
科目:高中化学 来源: 题型:
把0.6mol铜粉投入含0.8mol硝酸和0.2mol硫酸的稀溶液中,则标状况下放出的气体的物质的量为( )
A.0.2 mol B.0.3 mol C.0.4 mol D.0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
四种短周期元素在周期表中的位置如右图,其中只有M为金属元素。下列说法不正确的是
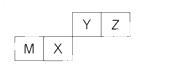
A.原子半径Z<M
B.Y的最离价氧化物对应水化物的酸性比X 的弱
C.X 的最 简单气态氢化物的热稳定性比Z的小
简单气态氢化物的热稳定性比Z的小
D.Z位于元索周期表中第2 周期、第ⅥA族
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实不能说明Cl原子的得电子能力比S原子强的是( )
①HCl比H2S稳定 ②HClO氧化性比H2SO4强
③HClO4酸性比H2SO4强 ④Cl2能与H2S反应生成S
⑤Cl原子最外层有7个电子,S原子最外层有6个电子
⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS
A.②⑤ B.①②
C.①②④ D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
位于短周期的四种元素A、B、C、D,其原子序数依次增大。A在周期表中原子半径最小;B是地壳中含量最高的元素;B、D位于同一主族;C的原子半径在同周期中最大。回答下列问题:
(1)写出由上述元素形成的具有漂白作用的3种物质的化学式:______、______、______。
(2)写出含B元素质量分数最高的化合物的电子式:___________________________
________________________________________________________________________。
(3)分别由A、B、C、D四种元素组成的两种化合物X和Y可以发生反应,试写出该
反应的离子方程式:________________________________________________________。
(4)用电子式表示化合物C2B的形成过程:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知分解1 mol H2O2 放出热量98KJ,在含少量I-的溶液中,H2O2的分解机理为:
H2O2+ I- →H2O +IO- 慢 H2O2+ IO-→H2O +O2+ I- 快
下列有关反应的说法正确的是( )
A.反应的速率与I-的浓度有关 B. IO-也是该反应的催化剂
C.反应活化能等于98KJ·mol-1 D.v(H2O2)=v(H2O)=v(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO。其过程如下:
mCeO2 (m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xH2O+ xCO2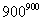 mCeO2+ xH2+ xCO
mCeO2+ xH2+ xCO
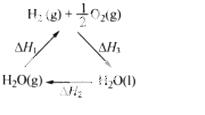 下列说法不正确的是
下列说法不正确的是
A.该过程中CeO2没有消耗
B.该过程实现了太阳能向化学能的转化
C.右图中△H1=△H2+△H3
D.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH——2e—=CO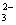 +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇是一种可再生能源,具 有广泛的开发和应用前景。
有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g)  CH
CH 3OH(g)+H2O(g) ΔH2
3OH(g)+H2O(g) ΔH2
①上述反应符合“原子经济”原则的是________(填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 | 250 ℃ | 300 ℃ | 350 ℃ |
| K | 2.041 | 0.270 | 0.012 |
由表中数据判断,ΔH1______0(填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为________,此时的温度为________(从上表中选择)。
H2充入2 L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为________,此时的温度为________(从上表中选择)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH1=-1 275.6 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566.0  kJ·mol-1
kJ·mol-1
③H2O(g)===H2O(l) ΔH3=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列依据相关实验得出的结论正确的是
A.利用一束强光照射明矾溶液,产生光亮的“通路”,说明明矾一定发生了水解
B.向盛有Fe(NO3)2溶液的试管中加入0.1 mol·L-1 H2SO4溶液,试管口出现红棕色气体, 说明溶液中NO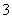 被Fe2+还原为NO2
被Fe2+还原为NO2
C.将某气体通入品红溶液中,品红褪色,说明该气体一定是SO2
D.向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2悬浊液,加热,无砖红色沉淀生成,说明淀粉没有水解生成葡萄糖
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com