
若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的变化。在变化的各阶段被破坏的粒子间的主要相互作用依次是( )
A.氢键;分子间作用力;极性键
B.氢键;氢键;非极性键
C.氢键;极性键;分子间作用力
D.分子间作用力;氢键;非极性键
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列表示式错误的是( )
A.Na+的轨道表示式: B.Na+的结构示意图:
B.Na+的结构示意图: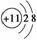
C.Na的电子排布式:1s22s22p63s1 D.Na的简化电子排布式:[Ne]3s1
查看答案和解析>>
科目:高中化学 来源: 题型:
原子形成化合物时,电子云间的相互作用对物质的结构和性质会产生影响。请回答下列问题:
(1)BF3分子的立体结构为______________,NF3分子的立体结构为____________。
(2)碳原子有4个价电子,在形成化合物时价电子均参与成键,但杂化方式不一定相同。在乙烷、乙烯、乙炔和苯四种分子中,碳原子采取sp杂化的分子是____________(写结构简式,下同),采取sp2杂化的分子是__________,采取sp3杂化的分子是____________。试写出一种有机物分子的结构简式,要求同时含有三种不同杂化方式的碳原子:________________________________________________________________________。
(3)已知H2O、NH3、CH4三种分子中,键角由大到小的顺序是CH4>NH3>H2O,请分析可能的原因是________________________________________________。
(4)由于电荷的作用,阴、阳离子形成化合物时离子的电子云会发生变化,使离子键逐渐向共价键过渡。阳离子电荷数越多,阴离子半径越大时,电子云变化越大,导致所形成的化合物在水中的溶解度越小。由此可知,四种卤化银(AgF、AgCl、AgBr和AgI)在水中的溶解度由大到小的顺序为________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知a是H,b是N,c是O,d是S,a与其他元素形成的二元共价化合物中,分子中既含有极性共价键,又含有非极性共价键的化合物是________________________________(填化学式,写出两种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
中科院国家纳米科学中心2013年11月22日宣布,该中心科研人员在国际上首次“拍”到氢键的“照片”,实现了氢键的实空间成像,为“氢键的本质”这一化学界争论了80多年的问题提供了直观证据。这不仅将人类对微观世界的认识向前推进了一大步,也为在分子、原子尺度上的研究提供了更精确的方法。下列说法中正确的是( )
A.正是氢键的存在,冰能浮在水面上
B.氢键是自然界中最重要、存在最广泛的化学键之一
C.由于氢键的存在,沸点:HCl>HBr>HI>HF
D.由于氢键的存在,水分子中氢氧键角是104.5°
查看答案和解析>>
科目:高中化学 来源: 题型:
铅是碳的同族元素,比碳多4个电子层。铅在元素周期表的位置为第________周期第________族;PbO2的酸性比CO2的酸性________(填“强”或“弱”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com