
 、
、 其数目分别用a、b、c、d表示,对烷烃(除甲烷外)中存在的关系作讨论:
其数目分别用a、b、c、d表示,对烷烃(除甲烷外)中存在的关系作讨论:分析 (1)根据烷烃的分子结构和构成情况来回答;
(2)根据烷烃的通式CnH2n+2来计算回答;
(3)根据条件书写烷烃的同分异构体,确定数目;
解答 解:(1)A、在直链烷烃中,两头是甲基,中间可以有无数个亚甲基,a的数目与b的数目的大小无关,故A正确;
B.c增加1,a增加3时只局限到了异丙烷,不合理,故B错误;
C.根据烷烃的命名原则和书写,d增加1,a就会增加2,故C正确;
D.b增加1,在亚甲基的两端挂上甲基,只能是丙烷一种物质,不可能,故D错误.
故选AC;
(2)根据烷烃的通式CnH2n+2,-CH3、-CH2-、 、
、 其数目分别用a、b、c、d表示,则烷烃的分子式为C(a+b+c+d)H(3a+2b+c),则:3a+2b+c=2(a+b+c+d)+2,整理得:a=2+c+2d;
其数目分别用a、b、c、d表示,则烷烃的分子式为C(a+b+c+d)H(3a+2b+c),则:3a+2b+c=2(a+b+c+d)+2,整理得:a=2+c+2d;
故答案为:2+c+2d;
(3)烷烃分子中,当b=c=d=1时,能组成的烷烃分别是:2,2,4-三甲基戊烷、2,2,3-三甲基戊烷、2,3,3-三甲基戊烷共三种同分异构体;
故答案为:3;2,2,4-三甲基戊烷.
点评 本题主要考查同分异构体书写,烷烃中C原子与H原子之间的数量关系,难度中等,限制条件的同分异构体书写是高考的热点,也是难点.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,Fe2+、NH4+、SO42-、S2-可以大量共存 | |
| B. | 该溶液中,H+、K+、NO3-、SO42-可以大量共存 | |
| C. | 向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+═Cl-+2Fe3++H2O | |
| D. | 向该溶液中加入浓硫酸,反应的离子方程式为:ClO2-+4H++3 Cl-=2Cl2↑+2 H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
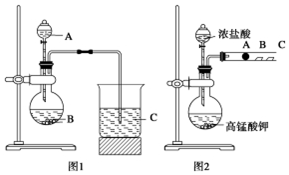
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
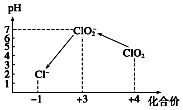 ClO2是一种黄绿色到橙黄色的气体,ClO2与Cl2的氧化性相近,被国际上公认为安全、低毒的绿色消毒剂,近几年我国用ClO2代替氯气对饮用水进行消毒.
ClO2是一种黄绿色到橙黄色的气体,ClO2与Cl2的氧化性相近,被国际上公认为安全、低毒的绿色消毒剂,近几年我国用ClO2代替氯气对饮用水进行消毒.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑥ | B. | ③④ | C. | ①⑤ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=2 | |
| B. | 2 min内A的反应速率为0.3 mol•(L•min)-1 | |
| C. | 维持其他条件不变,将该混合物转移到固定容积为1 L的密闭容器中,再次平衡后H的浓度将大于0.4 mol•L-1 | |
| D. | 维持其他条件不变,再向容器中加入足量物质 A,最终H的浓度将达到0.5 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol O2完全反应时,转移的电子数为0.4NA | |
| B. | 用惰性电极点解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA | |
| C. | 含1mol FeCl3的饱和溶液最多可形成胶体粒子数为NA | |
| D. | 1mol 葡萄糖与足量的钠反应能产生2.5mol H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com