
| A. | 用碱式滴定管准确量取20.00 mL的高锰酸钾溶液 | |
| B. | 用NaOH滴定盐酸时,若滴定结束时俯视刻度,会导致测定结果偏高 | |
| C. | 用NaOH滴定盐酸时,只能用酚酞作指示剂 | |
| D. | 用KMnO4滴定亚硫酸钠溶液的实验中不需要另外加入指示剂 |
分析 A.酸性高锰酸钾溶液能腐蚀碱式滴定管的胶管;
B.根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
C.用NaOH滴定滴定盐酸时,变色范围合适的指示剂除了酚酞,还可以用甲基橙;
D.KMnO4本身为紫色,则用KMnO4滴定亚硫酸钠溶液的实验到达终点时,将出现红色.
解答 解:A.酸性高锰酸钾溶液能腐蚀碱式滴定管的胶管,所以用酸式滴定管量取20.00mL酸性高锰酸钾溶液,故A错误;
B.用NaOH滴定盐酸时,若滴定结束时俯视刻度,导致V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,可知c(待测)偏小,故B错误;
C.用NaOH滴定滴定盐酸时,变色范围合适的指示剂除了酚酞,还可以用甲基橙,故C错误;
D.KMnO4本身为紫色,则用KMnO4滴定亚硫酸钠溶液的实验到达终点时,将出现红色,所以不需要另外加入指示剂,故D正确.
故选D.
点评 本题考查了滴定实验仪器的选用、误差分析、指示剂的选择等,题目难度中等,注意理解滴定的原理与操作.


科目:高中化学 来源: 题型:选择题
| A. | 向次氯酸钙溶液通入过量CO2:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| B. | 向Ca(HCO3)2溶液中加入少量的NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+H2O | |
| C. | 硫代硫酸钠溶液中加入硫酸:S2O32-+6H++2SO42-═4SO2↑+3H2O | |
| D. | 酸性溶液中KIO3与KI反应生成I2:IO3-+5I-+6H+═3I2+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 共价键 | 键能/ kJ•mol-1 | 共价键 | 键能/ kJ•mol-1 | 共价键 | 键能/ kJ•mol-1 |
| H-H | 436 | H-Br | 366 | Cl-Cl | 243 |
| H-O | 463 | H-I | 298 | Br-Br | 193 |
| H-Cl | 432 | O=O | 496 | I-I | 151 |
| A. | H2O中含有两个O-H共价键,故用氢气与氧气合成1 mol H2O放出的能量为926 kJ | |
| B. | 用单质合成1 mol H-Cl所放出的能量小于合成1 mol H-Br所放出的能量 | |
| C. | 当用表中卤素单质与氢气合成卤化氢时,所有的反应都是放热反应 | |
| D. | 合成溴化氢的热化学方程式为H2(g)+Br2(g)═2HBr(g)△H=+103 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 98.32kJ | B. | 196.64kJ/mol | C. | <196.64kJ | D. | >196.64kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知H2C2O4为二元中强酸.某化学兴趣小组为测定含Na2SO4、NaHC2O4和H2C2O4•2H2O的试样中各物质的质量分数,进行了如下实验:
已知H2C2O4为二元中强酸.某化学兴趣小组为测定含Na2SO4、NaHC2O4和H2C2O4•2H2O的试样中各物质的质量分数,进行了如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
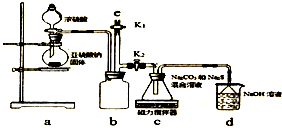 天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠泄漏,可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻环境污染.
天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠泄漏,可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻环境污染.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com