
 25℃时,电离平衡常数:
25℃时,电离平衡常数:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 | |
分析 (1)酸根离子对应的酸的酸性越强,酸根离子结合氢离子的能力越弱;
(2)酸性强弱为CH3COOH>H2CO3>HClO>HCO3-,强酸能够制取弱酸,据此对各选项进行判断;
(3)醋酸是弱电解质,加水稀释醋酸,促进醋酸电离,则n(CH3COO-)、n(H+)增大,n(CH3COOH)减小,但醋酸根离子、氢离子浓度增大的程度小于溶液体积增大的程度,所以c(CH3COO-)、c(H+)、c(CH3COOH)都减小,据此分析解答;
(4)加水稀释促进弱酸电离,pH相同的不同酸稀释相同的倍数,pH变化大的酸酸性强,变化小的酸酸性弱;酸或碱抑制水电离,酸中氢离子或碱中氢氧根离子浓度越大其抑制水电离程度越大;
(5)纯水电离生成的c(H+)=c(OH-),Kw=c(H+)×c(OH-),过量的c(OH-)=$\frac{0.9V-0.1V}{2V}$=0.4mol/L,结合Kw计算c(H+),得出pH;
解答 解:(1)电离平衡常数越大,越易电离,溶液中离子浓度越大,则酸性强弱为:CH3COOH>H2CO3>HClO>HCO3-,酸根离子对应的酸的酸性越强,酸根离子结合氢离子的能力越弱,则四种离子结合质子的能力由大到小的顺序是:CO32->ClO->HCO3->CH3COO-,即a>b>d>c,
故答案为:a>b>d>c;
(2)a.CO32-+CH3COOH═CH3COO-+CO2↑+H2O:碳酸的酸性小于CH3COOH,所以CH3COOH能够制取碳酸,该反应能够发生,故a错误;
b.ClO-+CH3COOH═CH3COO-+HClO:CH3COOH的酸性大于HClO,CH3COOH能够制取HClO,该反应能够发生,故b错误;
c.CO32-+HClO═CO2↑+H2O+ClO-:HClO的酸性小于碳酸,该反应无法发生,故c正确;
d.2ClO-+CO2+H2O═CO32-+2HClO:由于酸性H2CO3>HClO>HCO3-,则碳酸与次氯酸根离子反应只能生成碳酸氢根离子,不会生成CO32-,该反应不能发生,故d正确;
故答案为:cd;
(3)A.加水稀释醋酸促进醋酸电离,氢离子物质的量增大,醋酸分子的物质的量减小,所以$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$ 的比值减小,故A错误;
B.加水稀释醋酸促进醋酸电离,醋酸根离子物质的量增大,醋酸分子的物质的量减小,则$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的比值增大,故B正确;
C.加水稀释促进醋酸电离,但氢离子浓度减小,温度不变,水的离子积常数不变,所以$\frac{c({H}^{+})}{{K}_{W}}$ 的比值减小,故C错误;
D.加水稀释醋酸促进醋酸电离,氢离子浓度减小,温度不变,水的离子积常数不变,则氢氧根离子浓度增大,$\frac{c({H}^{+})}{c(O{H}^{-})}$的比值减小,故D错误;
故答案为:B;
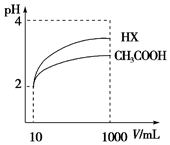
(4)加水稀释促进弱酸电离,pH相同的不同酸稀释相同的倍数,pH变化大的酸酸性强,变化小的酸酸性弱;酸或碱抑制水电离,酸中氢离子或碱中氢氧根离子浓度越大其抑制水电离程度越大,
根据图知,pH相同的醋酸和HX稀释相同的倍数,HX的pH变化大,则HX的酸性大于醋酸,所以HX的电离平衡常数大于常数,稀释后醋酸中氢离子浓度大于HX,所以醋酸抑制水电离程度大于HX,则HX溶液中水电离出来的c(H+)大于醋酸溶液水电离出来c(H+),
故答案为:大于;大于;
(5)纯水电离生成的c(H+)=c(OH-),Kw=c(H+)×c(OH-),过量的c(OH-)=$\frac{0.9V-0.1V}{2V}$=0.4mol/L,由该温度下的Kw可知,c(H+)=$\frac{4×1{0}^{-14}}{0.4}$=10-13mol•L-1,所以pH=13,故答案为:13.
点评 本题考查酸碱混合溶液定性判断,为高频考点,题目难度中等,涉及离子浓度大小比较、pH的简单计算等知识,试题知识点较多、综合性较强,充分考查学生分析判断能力及化学计算能力.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 mol A+2 mol B | B. | 3 mol C+2 mol D | ||
| C. | 1 mol B+3 mol C+1 mol D | D. | 2 mol A+1 mol B+3mol C+1 mol D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 进行蒸馏操作时冷凝管进水的方向是上进下出 | |
| B. | 用酒精萃取碘水中的碘 | |
| C. | 用蒸发方法使NaCl 从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干 | |
| D. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 萃取操作时,应选择有机萃取剂,萃取剂的密度不一定比水大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com