
| 实验操作与现象 | 实验结论 | |
| 步骤一 | 将该固体全部溶于于得无色溶液; | 肯定无Cu2+. |
| 步骤二 | 向上述溶液中加入足量盐酸,产生无色无味的气体共收集到2.24L(标准状况); | 肯定有CO32- 肯定无Ba2+ |
| 步骤三 | 向步骤二所得溶液中继续加入足量BaCl2溶液,产生沉淀,过滤并洗涤干燥后得46.6g白色沉淀. | 肯定有SO42- |
| 步骤四 | 向步骤三所得滤液中加入AgNO3溶液,得白色沉淀. |
分析 步骤一中得到无色溶液,一定不含Cu2+;
步骤二中加入足量盐酸,产生无色无味的气体共收集到2.24L(标准状况),气体为CO2,一定含CO32-,且n(CO32-)=$\frac{2.24L}{22.4L/mol}$=0.1mol;由离子之间不能结合生成沉淀可知,一定不含Ba2+;
步骤三中继续加入足量BaCl2溶液,产生沉淀,过滤并洗涤干燥后得46.6g白色沉淀,白色沉淀为硫酸钡,一定含SO42-,n(SO42-)=$\frac{46.6g}{233g/mol}$=0.2mol;
步骤四中,白色沉淀为AgCl,但步骤二、三中引入氯离子,不能确定原溶液中是否含Cl-,然后结合电荷守恒来解答.
解答 解:步骤一中得到无色溶液,一定不含Cu2+;
步骤二中加入足量盐酸,产生无色无味的气体共收集到2.24L(标准状况),气体为CO2,一定含CO32-,且n(CO32-)=$\frac{2.24L}{22.4L/mol}$=0.1mol;由离子之间不能结合生成沉淀可知,一定不含Ba2+;
步骤三中继续加入足量BaCl2溶液,产生沉淀,过滤并洗涤干燥后得46.6g白色沉淀,白色沉淀为硫酸钡,一定含SO42-,n(SO42-)=$\frac{46.6g}{233g/mol}$=0.2mol;
步骤四中,白色沉淀为AgCl,但步骤二、三中引入氯离子,不能确定原溶液中是否含Cl-,
故答案为:
| 实验操作与现象 | 实验结论 | |
| 步骤一 | 将该固体全部溶于于得无色溶液; | 肯定无Cu2+ |
| 步骤二 | 向上述溶液中加入足量盐酸,产生无色无味的气体共收集到2.24L(标准状况); | 肯定有CO32-, 肯定无Ba2+ |
| 步骤三 | 向步骤二所得溶液中继续加入足量BaCl2溶液,产生沉淀,过滤并洗涤干燥后得46.6g白色沉淀. | 肯定有SO42- |
| 步骤四 | 向步骤三所得滤液中加入AgNO3溶液,得白色沉淀. |
点评 本题考查无机物的推断,把握常见离子的检验方法、离子反应及电荷守恒为解答的关键,侧重分析与推断、应用能力的考查,题目难度不大.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:选择题
| A. | 气体甲可与Z的某种氢化物反应生成强酸 | |
| B. | 化合物乙中一定只有共价键 | |
| C. | W元素的某种单质可在电子工业用于生产半导体材料 | |
| D. | X分别与Y、Z、M、W形成的常见化合物中,稳定性最好的是XM |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
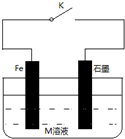
| A. | 常温下,关闭K时,若M溶液为浓硫酸,则石墨上有氢气放出 | |
| B. | 关闭K时,若M为氯化钠,则铁电极的电极反应式为:O2+4e-+2H2O═4OH- | |
| C. | 关闭K时,若M为则硫酸铵,则石墨极的电极反应式为:2H++2e-═H2↑ | |
| D. | 关闭K时,若M溶液为海水,石墨换成铜或银,则称为外加电流的阴极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -824.39 kJ•mol-1 | B. | +627.6 kJ•mol-1 | ||
| C. | -744.7 kJ•mol-1 | D. | -169.4 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷、丁烷、正戊烷的沸点依次降低 | |
| B. | 乙二醇、丙氨酸均可发生缩聚反应 | |
| C. | 蔗糖和麦芽糖水解的最终产物都是葡萄糖 | |
| D. | 饱和(NH4)2SO4溶液可导致蛋清液变性凝固 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,向100mL 0.l mol.L-lHCl的溶液p 中逐滴加入0.2mol.L-lMOH溶液的过程中,其pH变化如图所示(溶液体积变化忽略不计).下列说法中正确的是( )
常温下,向100mL 0.l mol.L-lHCl的溶液p 中逐滴加入0.2mol.L-lMOH溶液的过程中,其pH变化如图所示(溶液体积变化忽略不计).下列说法中正确的是( )| A. | MOH为一元强碱 | |
| B. | N点水的电离程度小于K点水的电离程度 | |
| C. | 在K点,c(M+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | K点对应的溶液中,有c( MOH)+c( M+)=0.2 mol.L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 自然界存在丰富的碳、氮、硅、磷、铁等元素,它们可形成单质及许多化合物.按要求回答下列问题:
自然界存在丰富的碳、氮、硅、磷、铁等元素,它们可形成单质及许多化合物.按要求回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com