
【题目】X、Y、Z、W为短周期主族元素,原子序数依次增大,X原子的最外层电子数是第一层电子数的2倍,Y的气态氢化物与最高价氧化物的水化物可形成盐,Z的最外层电子数与其电子总数比为3:8,下列说法正确的是![]()
A.X、Y、W的最高价含氧酸酸性顺序:![]()
B.Z、W可形成![]() 的化合物,属于离子化合物
的化合物,属于离子化合物
C.离子半径:![]()
D.气态氢化物的稳定性:![]()
【答案】C
【解析】
X、Y、Z、W为短周期主族元素,原子序数依次增大,Y的气态氢化物与最高价氧化物水化物可形成盐,则Y为N元素,X原子序数小于N元素,X原子的最外层电子数是第一层电子数的2倍,则X处于第二周期,X为C元素;Z的最外层电子数与其电子总数比为3:8,原子序数大于N元素,故Z处于第三周期,为S元素,W的原子序数最大,故W为Cl元素。
A.非金属性越强最高价含氧酸酸性越强,非金属性Cl>N>C,故最高价含氧酸酸性顺序:Cl>N>C,A错误;
B.Z、W可形成SCl2,属于共价化合物,B错误;
C.电子层结构相同核电荷数越大离子半径越小,则离子半径:S2->Cl-,C正确;
D.非金属性Cl>S,则HCl比硫化氢稳定,D错误。
故选C。


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】(1)镁原子由1s22s22p63s2→1s22s22p63p2时原子释放能量,由基态转化成激发态____。
(2)价电子排布为5s25p1的元素位于第五周期第ⅠA族,是s区元素______。
(3)凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键______。
(4)24Cr原子的电子排布式是1s22s22p63s23p63d44s2______。
(5) 金属铜属于六方最密堆积结构,金属镁属于面心立方最密堆积结构______。
(6)氯化钠晶体中,每个Na+周围距离相等的Na+共有12个______。
(7)金刚石为网状结构,由共价键形成的碳原子环中,最小的环上有6个碳原子______。
(8) 所有原子任一能层的s电子云轮廓图都是球形,但球的半径大小不同______。
(9)干冰晶体中,每个CO2分子周围紧邻12个CO2分子______。
(10) 模型中的小黑点表示电子在原子核外出现的概率密度的形象描述______。
模型中的小黑点表示电子在原子核外出现的概率密度的形象描述______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含MgCl2、AlCl3均为nmol的混合溶液,向其中滴NaOH溶液至过量。加入NaOH的物质的量与生成沉淀的物质的量的关系正确的是(离子(或物质)沉淀pH见表)
离子 | Mg2+ | Al3+ | 物质 | Al(OH)3 |
开始沉淀时的pH | 8.93 | 3.56 | 开始溶解时的pH | 8.04 |
完全沉淀时的pH | 10.92 | 4.89 | 完全溶解时的pH | 12.04 |
A. 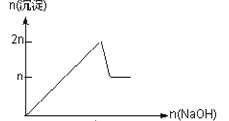
B. 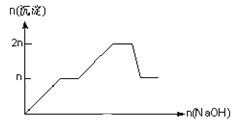
C. 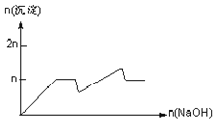
D. 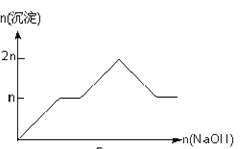
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家发现铂的两种化合物a和b(见图),实验测得a和b具有不同的性质,且a具有抗癌作用,而b没有。下列关于a、b的叙述错误的是 ( )

A.a和b互为同分异构体B.a和b的空间构型是平面四边形
C.a和b互为镜像的关系D.a和b分别是非极性分子和极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 所含共价键数均为0.4NA的白磷(P4)和甲烷的物质的量相等
B. 10g浓度为46%的乙醇水溶液中含有的氢原子总数为1.2NA
C. 2 g H2分别与足量的C12和N2充分反应后转移的电子数均为2NA
D. 1molFe(OH)3与含3molHI的溶液完全反应后,溶液中所含I-的数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计了如图所示装置。
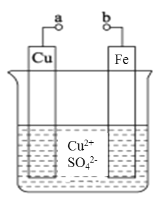
下列叙述不正确的是
A.a和b不连接时,Fe片上会有金属 Cu析出
B.a和b用导线连接时,Cu 片上发生的反应为Cu2++2e- =Cu
C.a和b导线连接时,电子从Fe 电极经溶液流向Cu电极
D.a和b用导线连接后.电流由Fe电极经导线流向Cu 电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:
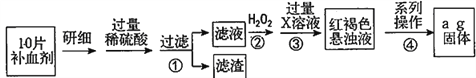
请回答下列问题:
(1)向操作①的滤液中滴加KSCN溶液后变为红色,则该滤液中含有______(填离子符号)。
(2)操作②中反应的离子方程式:__________________________________。
(3)操作③中反应的离子方程式:__________________________________。
(4)操作④中一系列处理的操作步骤:过滤、______、灼烧、_______、称量。
(5)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为______g。(用含a的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。
请回答下列问题:
(1)X、Y的元素符号依次是 _________、_________。
(2)XZ2与YZ2分子的立体构型分别是______________和_______________,相同条件下两者在水中的溶解度较大的是____________(写分子式)。
(3)Q的元素名称是_________,它在元素周期表中的位置是_________________,它的核外电子排布式为____________________,在形成化合物时它的最高化合价为___________。
(4)Y、Z、E三种元素原子的第一电离能由大到小的顺序是____________。(用元素符号表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、钾是农作物生长的必须营养元素,磷和钙都是促成骨骼和牙齿的钙化不可缺少的营养元素。回答下列问题:
(1)基态K的核外电子排布式为____________,基态N的价电子排布图为____________。
(2)元素的第一电离能:Ca________(填“>”或“<”)P。
(3)白磷P4在CS2中的溶解度________(填“大于”或“小于”)在水中的溶解度,N4是氮的一种新型单质,若N4分子结构类似于白磷P4,则N的杂化方式为________。
(4)下表是几种碳酸盐的热分解温度和阳离子半径:
碳酸盐 | CaCO3 | SrCO3 | BaCO3 |
热分解温度/℃ | 900 | 1172 | 1360 |
阳离子半径/pm | 99 | 112 | 135 |
根据上表数据分析碳酸钡分解温度最高的原因是_______________________
(5)常温下PCl5是一种白色晶体,晶体结构为氯化铯型,由A、B两种离子构成。已知A、B两种离子分别与CCl4、SF6互为等电子体,则A、B两种离子的符号分别为________、________。
(6)用晶体的X射线衍射法可以测得阿伏加德罗常数的值。已知金属钙的晶胞为面心立方(如图)晶胞,晶胞边长为d pm;又知钙的密度为ρ g/cm3,则一个钙晶胞的质量为________(用d、ρ表示,下同)g,阿伏加德罗常数的值为______________(化成最简式)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com